在全球范围内,有2%~4%的妊娠会并发先兆子痫,这是一种不可预测的进行性严重疾病。先兆子痫与每年约46,000名孕产妇死亡以及约500,000名胎儿和新生儿死亡相关1,2。疾病负担在中低收入国家或其他弱势群体女性中尤重。许多文献关注的是先兆子痫早产,它在所有病例中占1/3,并且孕产妇以及胎儿或新生儿并发症风险要比发生先兆子痫足月分娩时高得多。然而,先兆子痫足月分娩的患者人数要多得多,因此其所致先兆子痫相关发病率和死亡率也占相当大的数量。
产前检查方式主要是血压筛查,目的是发现高血压,尤其是先兆子痫。孕妇发生先兆子痫的生物和社会危险因素包括某些人口统计学特征(例如属于少数族裔)、内科或产科疾病史(例如慢性高血压)、当前妊娠的某些特征(例如通过辅助生殖技术受孕)、生理异常(例如血压升高)、实验室检查结果异常(例如重度贫血)和超声检查结果异常(例如多普勒超声检查测量出子宫动脉搏动指数异常)3(图1)。这些危险因素与先兆子痫的发病机制一致,发病机制包括子宫胎盘不匹配、合胞体滋养层因子以及血管生成因子失衡,它们导致孕妇全身内皮细胞失调和炎症,这一过程与脓毒症类似(图1)。
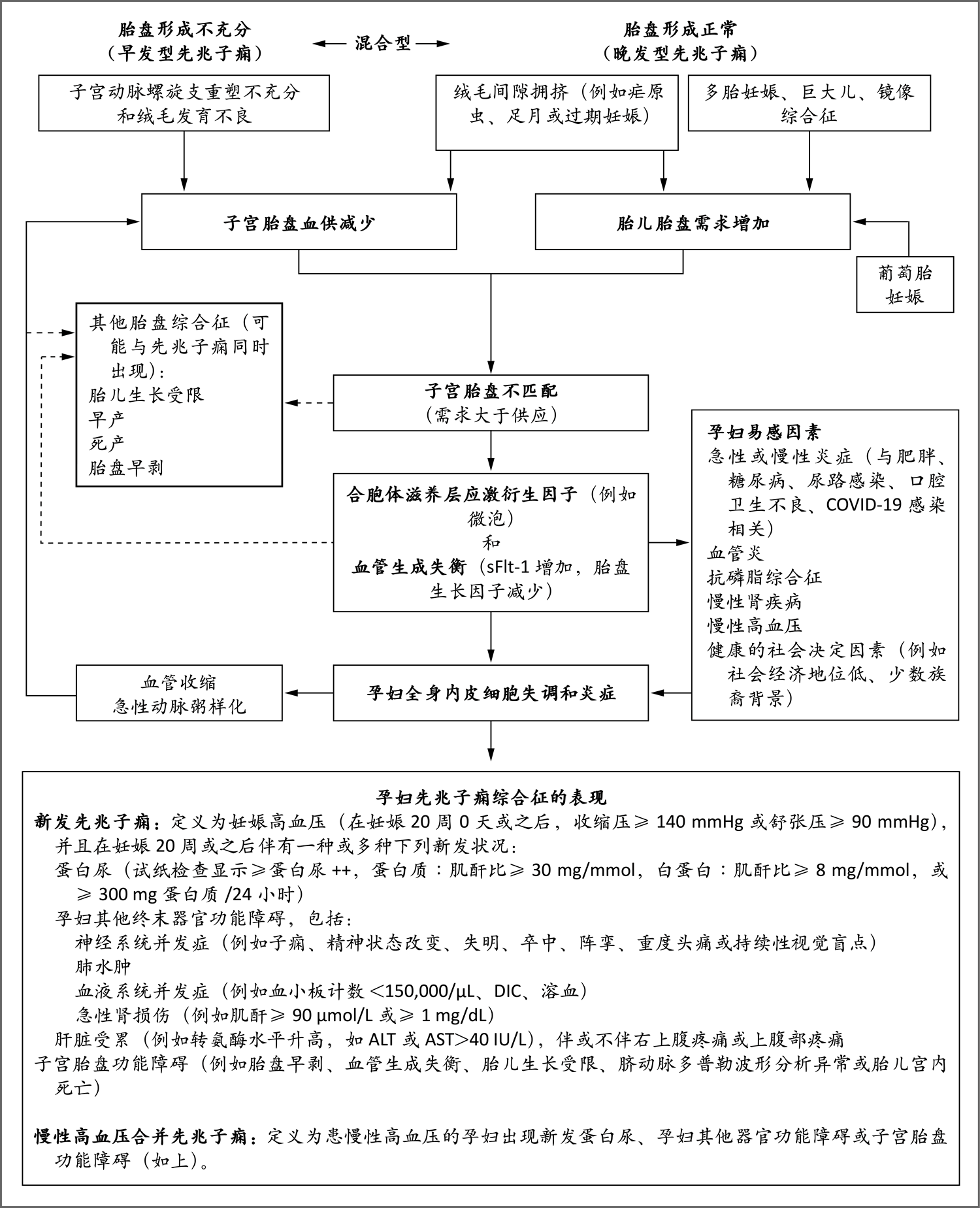 图1. 先兆子痫的发病机制
图1. 先兆子痫的发病机制
子宫胎盘血供减少、胎儿胎盘需求增加或这两者导致子宫胎盘不匹配。这导致胎盘合胞体滋养层应激衍生因子(例如促炎细胞因子或胎盘碎片)释放,以及循环系统内促血管生成的胎盘生长因子和抗血管生成的可溶性fms样酪氨酸激酶1(sFlt-1)发生失衡。如图中所示,这些因子的紊乱即使不太严重,也可导致具有易感性的孕妇患临床疾病。其结果是全身内皮细胞失调、全身过度炎症,以及最终孕妇和胎儿出现先兆子痫的表现。虚线箭头表明,即使无先兆子痫的临床表现,这些过程也可导致其他胎盘综合征。先兆子痫的表现尤其易发生于具有易感性的孕妇,而易感性与肥胖、糖尿病和慢性高血压等原有疾病相关。“混合型”表示发病机制的类型并非完全独立或明确。ALT表示丙氨酸转氨酶,AST表示天冬氨酸转氨酶,BP表示血压,COVID-19表示2019冠状病毒病,DIC表示弥散性血管内凝血。
大多数先兆子痫病例在足月时出现,症状轻微且短暂,分娩后很快消失。然而,有5%~20%的孕妇(尤其是在足月前出现先兆子痫的孕妇)会出现改变生活、危及生命或致死的并发症。导致全身水肿的全身内皮细胞损伤曾被视为一项诊断标准。心血管系统表现主要与外周血管阻力增加相关,这种情况下尽管血管内容量减少,但却导致高血压。针对影响风险的因素(例如孕妇年龄和体重)进行校正后,孕妇的心输出量正常,除非先兆子痫并发围产期心肌病。肺内皮细胞激活、中性粒细胞激活和血浆膨胀压降低会增加肺水肿和急性呼吸窘迫综合征的风险。重度高血压,尤其是收缩期高血压,会增加出血性卒中的风险,此外,高血压合并内皮细胞激活会导致后半球可逆性缺血性脑病(表现为头痛、盲点和光闪视)和子痫。目前尚不明确脑水肿是子痫的原因还是结果。
肾脏受累的最常见表现是蛋白尿,原因是肾小球内皮增生和相关的足细胞完整性丧失。严重时,这些病变可导致符合肾病的蛋白尿、急性肾小管坏死和急性肾损伤。
肝损伤的特征是门静脉周围炎症和肝细胞损伤(表现为右上腹疼痛或上腹部疼痛以及转氨酶升高)、包膜下血肿,以及见于少数病例的肝功能衰竭或肝破裂。黄疸和低血糖是罕见的后期表现,它们可以鉴别先兆子痫和妊娠期急性脂肪肝。
血液系统表现包括血液相对浓缩(除非发生溶血)、中性粒细胞相对增多、微血管血栓形成和溶血(表现为乳酸脱氢酶水平升高)、血小板消耗,以及尤其见于胎盘早剥情况下的弥散性血管内凝血。胎盘早剥的原因可能是孕妇子宫胎盘血管的缺血-再灌注损伤。
胎儿表现各异,包括胎儿生长受限(胎盘形成不充分所导致,通常见于早发型先兆子痫)和巨大儿(子宫胎盘不匹配的原因,通常见于晚发型先兆子痫)。早发型先兆子痫和晚发型先兆子痫均与围产期风险增加相关。
我们在本文中总结目前掌握的先兆子痫知识,尤其是过去5年间发表的研究结果。本文重点关注先兆子痫的预测、预防、诊断及妊娠期和长期管理的个体化,以及相关概念整合。虽然我们讨论的一些管理策略也适用于患慢性或妊娠高血压的孕妇,但重点是先兆子痫。
先兆子痫的预测
以下两种方法常用于确定先兆子痫风险增加以及可从预防性干预措施中获益的孕妇:临床危险因素的常规计数,以及对子宫胎盘灌注和功能进行临床、超声和实验室评估的多变量模型。虽然两种方法通常都是在妊娠早期应用,以确定可从小剂量阿司匹林预防性用药中获益的孕妇,但妊娠后期所做的评估也可确定可从加强监测和定时分娩中获益的孕妇。
大多数临床实践指南都提倡对先兆子痫风险进行常规筛查4。筛查方法包括在妊娠早期评估临床危险因素;这些危险因素被分别分析,并且汇总为无风险水平指征,或者汇总为导致高风险的因素计数或者导致中风险的一个或多个因素计数5。该方法简单,但对先兆子痫早产(约40%)和先兆子痫足月分娩(约35%)的检出率(即灵敏度)都较低,阳性筛查率(即筛查阳性率)约为10% 3。
多变量模型在妊娠11~13周用于先兆子痫早产,在妊娠35~36周用于先兆子痫足月分娩时,检出率高,阳性筛查率约为10%。英国胎儿医学基金会(Fetal Medicine Foundation,FMF)的竞争风险模型获得了大量证据支持,该模型包括其他模型中最常见的组成部分(即孕妇族裔背景、体质指数、血压、子宫动脉搏动指数的超声评估结果和血管生成标志物6)。FMF竞争风险方法是基于生存-时间模型,该模型结合了先兆子痫孕妇分娩时孕龄的先验分布(来自孕妇特征)以及来自生物标志物的似然函数,目的是估计个体孕妇在特定孕龄之前(例如37周之前)分娩时的先兆子痫风险3。
经过国际验证的FMF孕妇危险因素和生物标志物(即血压、多普勒超声测量的子宫动脉搏动指数和血清胎盘生长因子水平)模型可确定90%将发生早发型先兆子痫(妊娠34周之前)的妊娠11~13周孕妇,以及约75%将发生先兆子痫早产的孕妇,阳性筛查率为10% 3。子宫动脉多普勒超声检查和胎盘生长因子检测不属于常规检查项目,即使是在资源充足的临床机构亦如此。但可采用两步筛查程序,在该程序中,基于孕妇危险因素获得阳性筛查结果的孕妇有70%将接受第二阶段筛查(超声评估和血清生物标志物测定),这样能够以较低成本达到类似的先兆子痫早产总检出率3。黑种人孕妇和南亚裔孕妇需要接受第二阶段筛查的可能性高于其他族裔孕妇,但黑种人和南亚裔孕妇的先兆子痫早产检出率更高(>95%)3。如果两步筛查的第一步包括子宫动脉多普勒超声检查或胎盘生长因子检测,则在第二步中,胎盘生长因子测定或子宫动脉搏动指数评估只需用于30%~40%的孕妇3。
有90%的孕妇在妊娠11~13周被确定为先兆子痫早产的风险低,对于这一人群,妊娠中期和晚期的再次筛查可改进风险分层,并确定需要更密切监测的孕妇。在妊娠19~24周的常规超声检查中,再次筛查可确定几乎所有将在妊娠32周前发生先兆子痫的孕妇。妊娠32周时,再次筛查可确定90%将在妊娠32~35周发生先兆子痫的孕妇。然而,只有在妊娠35~36周才有可能预测先兆子痫足月分娩,可溶性fms样酪氨酸激酶1(sFlt-1)独立发挥作用7;在妊娠35~36周采取的这一筛查方法分别可确定75%和85%将发生先兆子痫足月分娩的孕妇,阳性筛查率分别为10%和20%。
预防
先兆子痫的预防是医疗工作的重中之重,因为先兆子痫一旦发生,就只有娩出胎盘才可缓解疾病。预防性治疗是基于先兆子痫的发病机制,重点是纠正血管生成失衡、内皮细胞激活、氧化应激、炎症、血管收缩或上述几种因素的组合(图1)。证据表明,运动、阿司匹林、钙和引产是有效的预防策略(图2)。
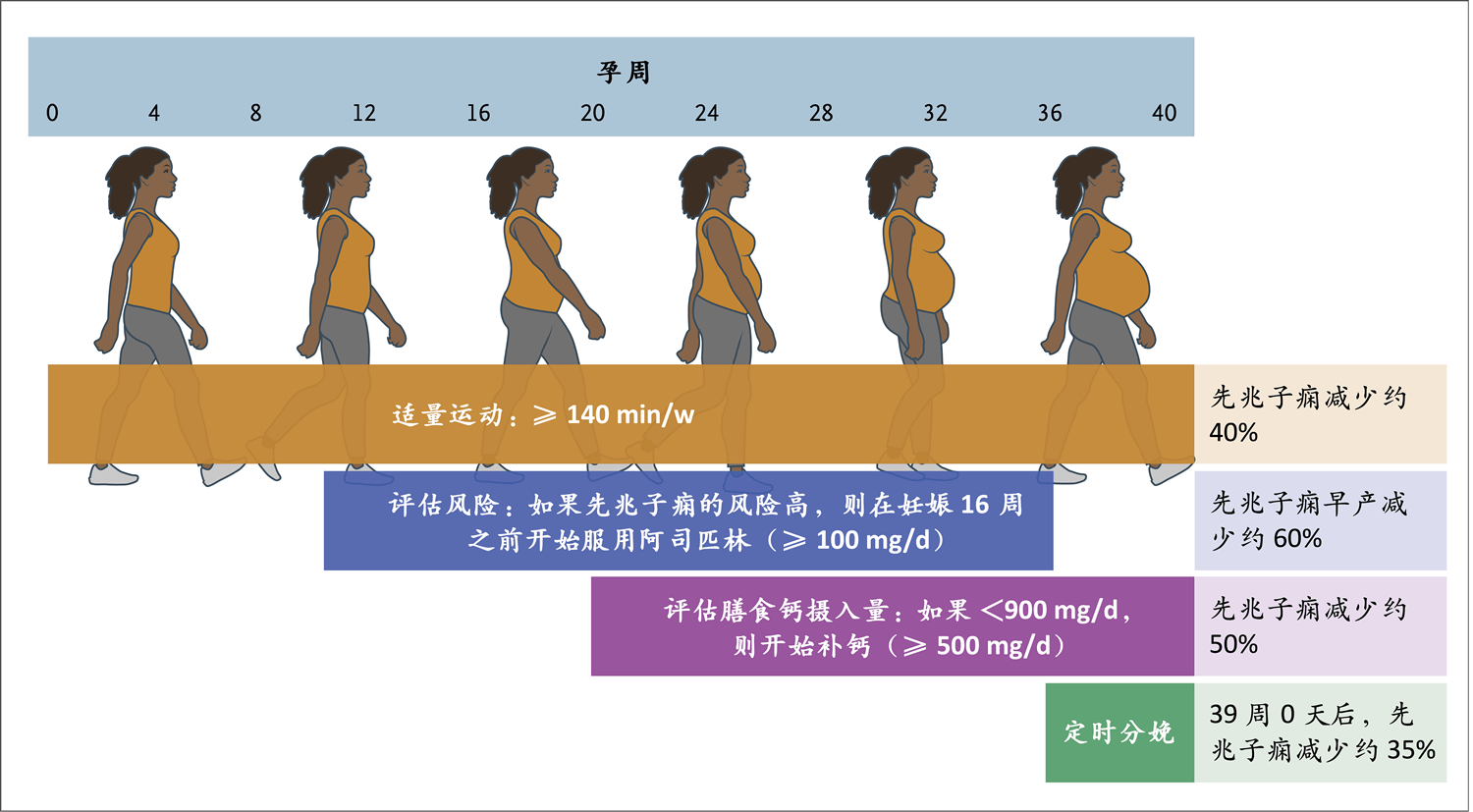 图2. 先兆子痫的预防
图2. 先兆子痫的预防
应鼓励孕妇参与运动,以降低先兆子痫风险,并促进身体健康。在妊娠16周之前,应确定先兆子痫风险高的孕妇,并给予阿司匹林(≥100 mg/d)。钙摄入量低的孕妇应在妊娠后半程补钙,剂量至少500 mg/d。风险低的未经产孕妇可从妊娠39周(妊娠39周0天至39周4天)引产中获益。
运动
一项包含15项随机对照试验,共计3,322名孕妇的系统综述表明,运动可降低先兆子痫的风险(比值比,0.59;95%置信区间[CI],0.37~0.90),并且对胎儿无不良影响8。为了实现这些益处,孕妇每周必须进行至少140分钟的中等强度运动,运动强度要足以提高心率,并达到可说话但无法唱歌的程度。
阿司匹林
对60项试验,共计36,716名先兆子痫发生风险高(主要基于临床危险因素)的孕妇进行的荟萃分析表明,阿司匹林(50~162 mg/d,通常≤75 mg/d)以剂量依赖性方式降低了先兆子痫风险(相对危险度,0.82;95% CI,0.77~0.88),此外还降低了孕产妇严重并发症、早产、小于胎龄儿以及胎儿或新生儿死亡的发生率9。在ASPRE(Combined Multimarker Screening and Randomized Patient Treatment with Aspirin for Evidence-Based Preeclampsia Prevention,多标志物筛查联合患者随机接受阿司匹林治疗,用于先兆子痫的循证预防)试验中,研究者通过多变量妊娠早期筛查来确定高危孕妇人群,并将其随机分配接受阿司匹林(150 mg/d)或安慰剂,开始用药时间为妊娠11~13周,结束用药时间为妊娠36周。在阿司匹林组中,先兆子痫早产的风险降低了60%以上(比值比,0.38;95% CI,0.20~0.74),但未观察到先兆子痫足月分娩显著减少(比值比,0.95;95% CI,0.57~1.57)10。该方法在加拿大11和以色列12具有成本效益。
后续对16项试验,共计18,907名孕妇进行的荟萃分析表明,阿司匹林对预防先兆子痫早产有益(相对危险度,0.62;95% CI,0.45~0.87),但对预防先兆子痫足月分娩无益(相对危险度,0.92;95% CI,0.70~1.21),但前提是在妊娠16周之前开始用药,并且剂量至少为100 mg/d 13。上述效应可能与主要发病机制的差异或者确诊时间变成较晚孕龄相关,因此可能有先兆子痫足月分娩得到了预防,但之前的部分先兆子痫早产变成了先兆子痫足月分娩,最终导致先兆子痫足月分娩数量无显著变化。不同地区上市的阿司匹林剂量存在差异;75 mg和81 mg片剂可互换使用,可能需要尽可能接近推荐剂量。我们有必要通过进一步研究来阐明为什么患慢性高血压的孕妇未能从阿司匹林中获益10。
应用阿司匹林预防先兆子痫与产前和产后出血以及罕见的新生儿出血小幅增加相关,其依据是一项基于人群的队列研究(共纳入4,088名接受阿司匹林治疗的孕妇14)和29项随机对照试验(共纳入30,775名孕妇9)。上述风险可通过在妊娠36周前停用阿司匹林来降低,此外,高危孕妇接受先兆子痫预防的获益远远超过风险。然而,由于上述风险,我们反对将阿司匹林普遍预防性用药作为风险筛查的替代方案。
钙
对30项试验,共计20,445名孕妇进行的荟萃分析表明,妊娠期补钙可降低先兆子痫足月分娩或早产的风险(相对危险度,0.49;95% CI,0.39~0.61),不论是在妊娠20周之前、之时还是之后开始补钙,不论是否同时补充维生素D,也不论采用大剂量(≥1 g/d)还是小剂量(通常为500 mg/d)15。然而,补钙仅对24项试验中共计15,050名基线平均钙摄入量低(<900 mg/d;相对危险度,0.45;95% CI,0.35~0.58)的孕妇亚组有效15。在对25项试验,共计15,038名孕妇进行的网络荟萃分析中,大剂量和小剂量补钙具有相似效果(相对危险度,0.79;95% CI,0.43~1.40)。
其他预防措施
一项纳入6,106名低危未经产孕妇的试验表明,与期待疗法相比,在妊娠39周0天至39周4天引产可降低妊娠高血压和先兆子痫的风险16。
普伐他汀作为潜在的预防药物受到了广泛关注。一项研究纳入了1,120名孕妇,并在妊娠35~36周时根据多变量筛查将其确定为发生先兆子痫足月分娩的风险高,结果表明尽管孕妇对用药方案的依从性高,但普伐他汀(20 mg/d)既未降低先兆子痫发病率,也未降低循环系统内的血管生成标志物水平17。评价妊娠早期启动普伐他汀预防性用药的多项试验正在进行中。
在一项纳入2,464名高危孕妇的试验中,叶酸(4 mg/d)未能预防先兆子痫18。低分子量肝素的效果尚不确定,在有高质量数据证明其安全性和效力之前,不建议在研究方案之外用药19。正在评估的较新候选药物(例如二甲双胍20)属于老药新用,而这些药物用于其他适应证的安全性已获得认可21。
高危孕妇监测
对于妊娠早期多变量或临床危险因素筛查确定为先兆子痫风险增加的孕妇,目前尚无任何经证实可降低孕妇或围产期风险的孕妇和胎儿标准化监测项目。应鼓励孕妇自我监测先兆子痫的可能症状,包括孕妇症状(例如头痛)和胎儿症状(例如胎动减少)。自我监测血压已经很普遍,尤其是COVID-19疫情开始以来,但目前尚不明确这样做可否更早发现先兆子痫。具有潜在效果的实用方法包括增加产前检查频率,孕妇自我监测蛋白尿,孕妇每月接受关于终末器官受累情况的实验室检查(血小板减少症、肌酐或转氨酶水平升高或者血管生成失衡),以及妊娠晚期胎儿评估(超声监测胎儿生长情况,或者多普勒流速仪测量脐动脉和大脑中动脉搏动指数)。
诊断
诊断先兆子痫的目的是发现有不良结局风险的孕妇,并制订最佳治疗方案。先兆子痫的传统定义是在妊娠20周或之后新发高血压和蛋白尿。逐渐形成的国际共识是,定义应该宽泛,从而涵盖其他相关形式的孕妇终末器官受累和子宫胎盘功能障碍(图1)。对33项观察性研究,共计9,426名疑似先兆子痫孕妇进行的系统综述表明,血管生成失衡与不良妊娠结局22(包括足月妊娠的孕妇)之间存在关联23。基于这些发现,血管生成失衡是2021年国际妊娠期高血压研究学会(International Society for the Study of Hypertension in Pregnancy,ISSHP)制定的先兆子痫定义的一部分24。应用血管生成标志物时,难点包括标志物数量有限以及具有不同截点的各种检测法,尤其是未针对孕妇特征或孕龄进行校正的检测法3。对于原有高血压的孕妇,要诊断为合并先兆子痫,应基于高血压以外的其他表现,而不仅仅是高血压恶化24。
先兆子痫根据发病时的孕龄分成不同亚组。早发型先兆子痫(妊娠34周之前)孕妇比晚发型先兆子痫(妊娠34周或之后)孕妇更有可能出现终末器官受累、胎儿生长受限以及低心输出量和高外周血管阻力的血流动力学特征25。在晚发型先兆子痫孕妇中(这一类型在所有先兆子痫孕妇中占至少70%),胎儿出生体重通常正常或者甚至增加,心输出量可能增加,外周血管阻力各异(即降低25或增加26)。
治疗
治疗机构
对于未伴发重度高血压,也未发生孕产妇和胎儿严重受损的先兆子痫孕妇,可考虑在门诊治疗(表1)。要达到门诊治疗的条件,孕妇必须知晓疾病进展的症状,有能力自行测量血压,与治疗团队保持顺畅沟通,并且住在距离医院30分钟路程范围内。
表1. 先兆子痫风险和根据诊断时的孕周采取的治疗方案*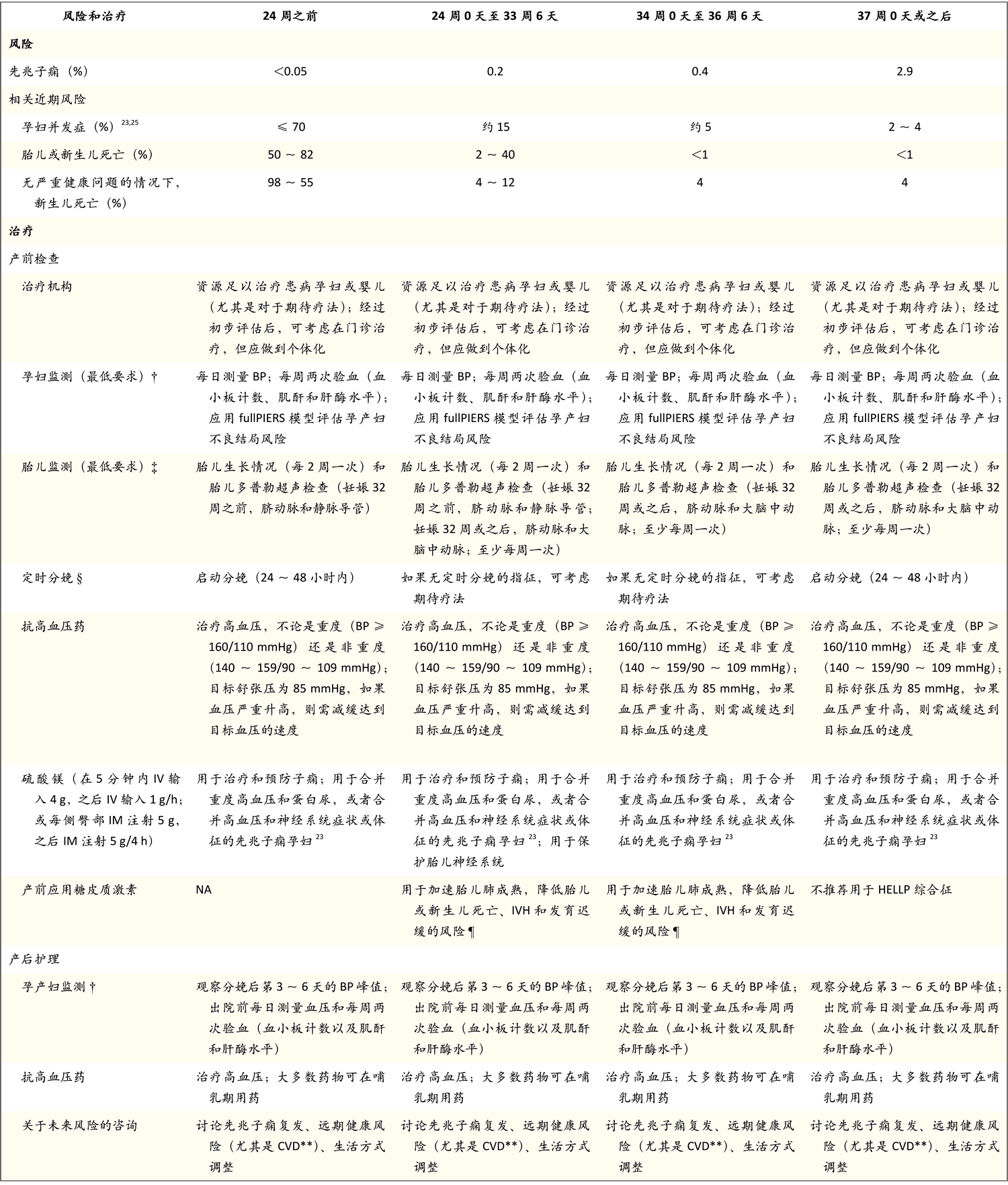
* BP表示血压;CVD表示心血管疾病;fullPIERS表示先兆子痫综合风险估计(Preeclampsia Integrated Estimate of Risk);HELLP表示溶血、肝酶升高和血小板减少;IM表示肌内;IV表示静脉内;IVH表示脑室内出血;NA表示不适用。
† 孕产妇监测在分娩后应继续,尤其是产生第一周。
‡ 目前尚无任何监测项目被证明可最大限度降低胎儿或新生儿不良结局风险。
§ 约40%的先兆子痫早产孕妇适合期待疗法。定时分娩(在任何孕龄)的适应证包括异常神经系统表现(例如子痫、重度顽固性头痛或反复出现视觉盲点)、在接受三类抗高血压药维持治疗的情况下仍反复出现重度高血压、肺水肿、进行性血小板减少症或血小板计数低于50×109/L、输入任何血液制品、血清肌酐水平异常且升高、肝酶水平异常且升高、肝功能障碍(在未发生弥散性血管内凝血且未接受华法林治疗的情况下,国际标准化比>2)、肝血肿或破裂、胎盘早剥伴孕妇或胎儿受损迹象或者胎儿状态不容乐观(包括死亡)。如果考虑定时分娩,应与麻醉科、新生儿科、母胎医学科和产科讨论(如果可能)。
¶ 孕龄上限根据当地方针决定。
‖ 有关更多信息,请参见LactMed数据库(https://www.ncbi.nlm.nih.gov/books/NBK501922/)。
** 我怀孕后的健康(My Health beyond Pregnancy)工具提供了有关CVD风险的信息,可帮助追踪BP、体重和其他CVD危险因素(https://www.preeclampsia.org/public/frontend/assets/img/gallery/pream21/MyHealthBeyondPregnancyFINAL.pdf)。
监测
对于先兆子痫孕妇,可通过经外部验证的fullPIERS(Preeclampsia Integrated Estimate of Risk,先兆子痫综合风险估计)模型预测孕产妇不良结局(通过Delphi获得的,关于死亡率和严重疾病患病率的复合指标,与14项孕产妇核心结局一致27[表2]),前提是每周至少评估两次其构成部分。构成部分包括孕龄、胸痛或呼吸困难、脉搏血氧测定、血小板计数、血清肌酐水平以及天冬氨酸或丙氨酸转氨酶水平28,29。可使用在线计算器进行计算(https://pre-empt.obgyn.ubc.ca/home-page/past-projects/fullpiers/)。
表2. 先兆子痫的孕产妇和围产期核心结局*
* 结局来自Duffy等的论文27。
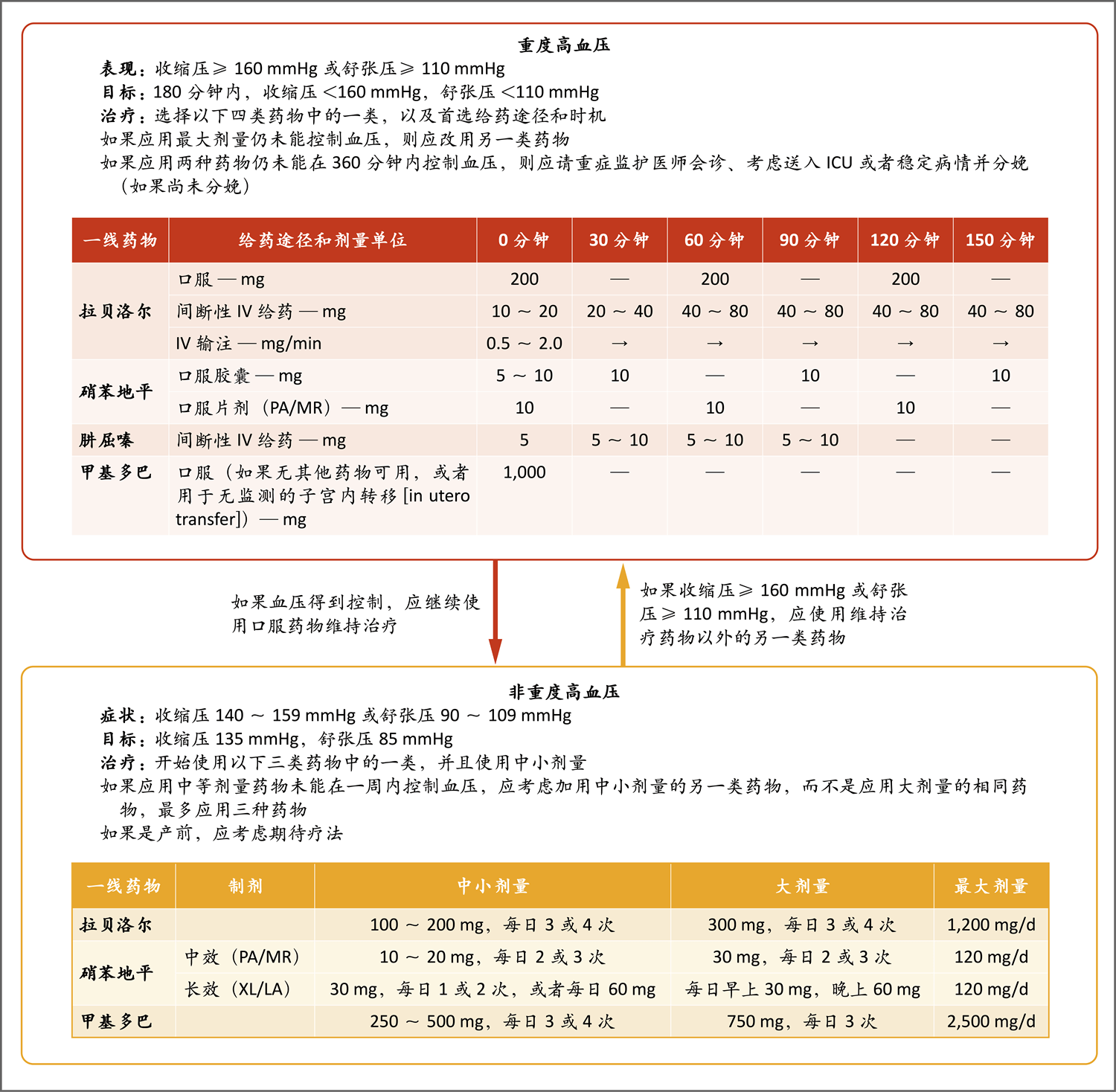 图3. 血压管理
图3. 血压管理
图中信息改编自Magee等的论文24。如红色框所示,重度高血压(收缩压≥160 mmHg或舒张压≥110 mmHg)需要紧急治疗。通过口服或非消化道给药,在数小时内达到低于160/110 mmHg的目标血压。在接下来数小时内,目标血压是135/85 mmHg,方法见橙色框。ICU表示重症监护病房,IV表示静脉内,LA表示长效,MR表示缓释,PA表示缓释,XL表示长效。
纳入疑似先兆子痫孕妇的前瞻性研究表明,测量胎盘生长因子或者sFlt-1:胎盘生长因子比有助于识别将在未来1~4周内分娩且合并先兆子痫的孕妇30,31。然而,与根据fullPIERS预测孕产妇不良结局相比,补充血管生成标志物可能无法改进预测结果32,33。一项采用阶梯设计的随机试验纳入了1,035名主要因高血压恶化、新发蛋白尿、头痛或视觉症状就诊的孕妇,结果表明,知晓胎盘生长因子水平可降低孕产妇不良结局的发生率34。而在一项采用类似阶梯设计的临床试验中,知晓胎盘生长因子水平并无益处;该试验纳入了2,291名最常见表现为疑似胎儿生长受限,并且血液检查结果与先兆子痫吻合的孕妇35。最后,一项纳入370名疑似先兆子痫孕妇的单中心随机试验表明,知晓sFlt-1:胎盘生长因子比未能减少住院人数,也未能降低分娩时的孕龄36。
各种胎儿监测策略(包括评估胎儿生长情况和多普勒超声检查)常被用于先兆子痫的管理。支持特定策略的高质量研究数据有限。
定时分娩
先兆子痫在分娩之后开始缓解,但产妇终末器官并发症有可能在产后继续恶化,尤其是分娩后3天内。尽管较早实施计划的分娩可以最大限度降低孕产妇面临的风险,但可能增加新生儿面临的风险,尤其是在早产的情况下。
对于先兆子痫病例,如果孕妇并发症和胎儿死亡的风险均较高,建议早期(孕龄<24周0天)启动分娩,如果观察到孕产妇或胎儿严重并发症,建议任何孕龄启动分娩,如果无并发症,建议足月时(孕龄≥37周0天)启动分娩,目的是最大限度降低孕妇风险,同时不增加新生儿风险24。
如果对患病孕产妇和新生儿的治疗准备工作已就绪,则从胎儿具备存活能力至妊娠36周6天,应优先讨论先兆子痫的期待疗法(即观察等待并密切监测分娩指征),而不是启动分娩24。一项纳入6项试验,共计748名孕妇的荟萃分析表明,与早期分娩相比,将期待疗法持续至妊娠33周6天与新生儿发病率降低相关37。纳入共计1,604名孕妇的2项试验表明,从妊娠34周0天至妊娠36周6天,期待疗法与孕妇发病率增加相关,但与新生儿送入新生儿病房的风险和呼吸系统发病率降低相关38,39,尤其是产前常规给予糖皮质激素,以加速胎儿肺成熟并降低其他早产相关风险的情况下38。
药物疗法
目前,对于确诊的先兆子痫,并无可缓解疾病的疗法。对潜在干预措施开展的随机试验几乎全部关注早发型先兆子痫和延长妊娠期的结局。有多项试验正在进行中。在靶向先兆子痫发病机制相关通路的试验中(图1),一项纳入180名孕妇的试验提示,二甲双胍(每日3 g剂量)很有前景40。新方法包括旨在清除抗血管生成因子(即sFlt-1)的血浆置换、单克隆抗体(抗肿瘤坏死因子α或补体),以及靶向sFlt-1生成或血管紧张素原的基因沉默策略21。
抗高血压治疗
重度高血压与孕产妇和围产期不良结局相关(这一相关性独立于先兆子痫),并且与先兆子痫和不良结局的相关程度相似41,因此需要抗高血压治疗4(图3)。大多数指南推荐口服硝苯地平、拉贝洛尔非消化道给药或肼屈嗪非消化道给药4。对32项试验,共计3,236名孕妇进行的网络荟萃分析和试验序贯分析表明,在达到目标血压方面,拉贝洛尔非消化道给药的疗效似乎与肼屈嗪非消化道给药和口服硝苯地平相似42,但根据对17项试验、共计1,591名孕妇进行的荟萃分析,口服硝苯地平的疗效似乎优于肼屈嗪非消化道给药43。口服拉贝洛尔与口服硝苯地平同样有效,并且口服拉贝洛尔时,被送入新生儿重症监护病房的低出生体重儿较少(10% vs. 口服硝苯地平后18%)44。单纯口服甲基多巴可使至少60%的孕妇达到目标血压44。
根据国际妊娠期高血压控制研究(International Control of Hypertension in Pregnancy Study)的结果(纳入987名孕妇),世界卫生组织、ISSHP、国际妇产科医学联合会(International Federation of Gynecology and Obstetrics)和美国以外的6份国家指南4,45,46建议对妊娠期非重度高血压进行治疗47。对于患慢性高血压或妊娠高血压的孕妇,以85 mmHg为目标舒张压给予的抗高血压治疗(最常用的药物是口服拉贝洛尔)使孕妇在随机分组后达到了133/85 mmHg的平均血压,而且这些孕妇比使用最少药物的孕妇更不易发生重度高血压(与既往小规模试验结果相同48),血小板计数小于100×109/L,或者有症状的肝酶水平升高47;先兆子痫孕妇留在最初分组中49。出生体重低于第10百分位的婴儿非显著增加被早产婴儿非显著减少所平衡,并且胎儿和新生儿死亡并未增加,对长时间新生儿护理的需求也未增加49。近期发表的慢性高血压和妊娠(Chronic Hypertension and Pregnancy)试验(纳入2,408名孕妇)也表明,血压控制(达到<140/90 mmHg,最常用药物是口服拉贝洛尔)与复合不良结局(有严重表现的先兆子痫、妊娠35周前发生的有医学指征的早产、胎盘早剥或者胎儿或新生儿死亡)减少相关,并且出生体重低于相应胎龄第10百分位的婴儿并未显著增加50。
根据纳入共计4,723名孕妇的49项小规模随机对照试验,通常推荐采用口服拉贝洛尔、甲基多巴或硝苯地平48。在纳入1,723名孕妇的22项试验中,上述任意两种药物之间无明显差异,但95%置信区间范围涵盖了有临床意义的获益和风险,此外关于儿童发育的随访数据虽然有限,但令人安心51。使用拉贝洛尔(α和β受体阻滞剂)或单纯β受体阻滞剂时,可能有必要监测新生儿的低血糖和心动过缓52。肾素-血管紧张素-醛固酮抑制剂对胎儿有毒性,因此妊娠期禁用53。
有人建议,对于先兆子痫孕妇,抗高血压治疗应由血流动力学评估结果来指导,外周血管阻力(以及血管内液体)增加时使用血管扩张剂,心输出量高时使用β受体阻滞剂。关于通过血流动力学指导的抗高血压治疗(与经验疗法相比)可否达到通常的目标血压,目前尚未开展随机试验。然而,在迄今已发表的最大规模试验中(纳入216名孕妇),血浆容量扩张(与常规治疗相比)与至分娩的时间较短、肺水肿和剖宫产发生率较高相关54。对于不伴有急性肾损伤的先兆子痫孕妇,建议谨慎补液(即待产期间每小时约80 mL)55。
硫酸镁
硫酸镁可有效预防和治疗先兆子痫,但给药过程有一定挑战(表1)4,24,56。目前正在评估替代方案(较小剂量或较短持续时间)、更具针对性地用于最有可能获益的孕妇以及可以良好控制血压的补充策略44。
糖皮质激素
产前糖皮质激素用药应遵循当地根据孕龄制定的指南,其目的是加速胎儿肺成熟,预防胎儿或新生儿死亡、脑室内出血和发育迟缓(表1)。不建议将糖皮质激素用于HELLP(溶血、肝酶升高和血小板减少)综合征;一项纳入11项试验、共计550名HELLP综合征孕妇的荟萃分析表明,实验室数值的短暂改善未能转化为临床结局的改善24。
产后管理
先兆子痫有可能首发于产后,而此时产妇并发症和死亡的风险最高57。由于血管外液体重新分布,因此血压在分娩后大约3~6天达到峰值,而此时大多数产妇已经出院。产后高血压是再次住院的常见指征58。尽管用于产后镇痛的非甾体抗炎药有可能升高血压,但纳入共计213名孕妇的两项试验结果并不一致59,60。有限的数据提示,抗高血压药在产后用药有效61,并且大多数(包括一些血管紧张素转化酶抑制剂)可在哺乳期用药(参见LactMed数据库)62。在一项纳入61名孕产妇的研究中,分娩后6周内自我监测血压并且将抗高血压药逐渐减量停药可增加6个月时血压正常的产妇百分比(80% vs. 常规治疗62%),并且约7 mmHg的舒张压降幅在3.6年后仍维持 63。
根据对17项研究进行的系统叙述性综述,产后先兆子痫与精神健康问题发病率增加相关64。
未来妊娠时面临的风险
对22项研究(这些研究纳入了共计99,415名既往妊娠期发生过先兆子痫的女性)中的个体参与者数据进行的荟萃分析表明,在后续妊娠中,15%的女性患妊娠高血压,15%患先兆子痫65。如果既往先兆子痫属于早发型或伴有并发症,则复发率可能高达50%。妊娠间隔期采取的措施,例如减重和运动,有可能降低先兆子痫复发风险。
远期风险
如果是基于每名女性(而非每次妊娠)进行计算,则先兆子痫发病率会翻倍,因为平均而言,每名女性至少有两个孩子66。因此,4%~8%的女性将在其一生中至少发生一次先兆子痫。
稳健的流行病学数据确定了先兆子痫与女性远期心血管危险因素及疾病之间的关联,而它们是导致女性死亡的主要原因。根据15项研究(1,646名女性在妊娠期患高血压,6,395名女性在妊娠期无并发症)的数据,先兆子痫(与妊娠期血压正常相比)与高血压风险增加至约4倍相关,尤其是在分娩后2年内67,并且与2型糖尿病和血脂异常风险翻倍相关68。先兆子痫使患心血管疾病的概率至少翻倍(基于对共计26项研究进行的两项系统综述),尤其是发生重度69或复发性先兆子痫时(基于纳入共计52,544名女性的7项研究)70。有报道指出后代出现类似的心血管不良结局71。此外,先兆子痫还与其他健康问题相关,例如惊厥发作、痴呆、慢性肾疾病,甚至全因死亡68。
先兆子痫和心血管风险之间的关联机制很复杂。先兆子痫和心血管疾病之间有共同的明确危险因素(例如患高血压)。女性可能有其他亚临床心脏或血管异常(例如外周血管阻力增加),使其在妊娠期易患血管或代谢疾病68,72。此外,理论上,先兆子痫本身有可能损害孕妇心血管系统。然而,针对常规心血管危险因素所做的校正完全73,74或几乎完全75消除了所观察到的妊娠期高血压(包括先兆子痫)和心血管疾病之间的任何关联。此外,关于因采取期待疗法,孕妇长期暴露于先兆子痫对心血管疾病所产生的影响,目前不同研究得出了不一致的估计值76,77。
美国心脏学会(American Heart Association)将妊娠期高血压(包括先兆子痫)列为心血管主要危险因素,并建议发生上述情况的女性在分娩后3个月内接受心血管风险筛查78。然而,目前尚无心血管预测模型能够充分说明年轻女性的10年风险,而在基于大规模人群的队列中开发定制模型的工作也未获成功79。更复杂的是,降低产后心血管风险的工作受到以下几个因素的挑战:患者参与度欠佳,脱落率高,以及尚未证实在降低心血管事件远期风险方面的效果。但仍有许多心血管危险因素是可以调整的,并且与生活方式相关80,因此,根据国家或国际指南,对于有先兆子痫史的所有女性,至少应提出生活方式方面的建议24。
未来方向
通过对生物标志物(孕产妇、胎儿或胎盘)以及多变量动态模型所做的研究,我们有可能在治疗方面取得进展。此类生物标志物和模型有可能帮助我们获得关于先兆子痫表型的新认识,改进先兆子痫的预测和管理,以及将妊娠期和之后的治疗方案个体化。