肝移植于60年前首次在人类身上实施,现已成为危及生命肝病患者的标准治疗方法(见补充附录表S1,补充附录与本文全文可在NEJM.org获取)。然而,对患者、医务人员和社会而言,这仍然是一种难度很大的治疗方法。本文重点介绍肝移植(尤其是成人肝移植)的最新进展,并简要讨论影响儿童肝移植的因素。
肝移植在可及性方面的挑战
尽管2020—2021年有100多个国家实施了至少一例肝移植,但在全球范围内,大多数危及生命的肝病患者并没有机会接受肝移植(图S1)1。在美国,以下人群接受肝移植的机会小:黑种人、贫困人群、农村居民、健康知识贫乏人群和无医疗保险人群2-4。2022年,美国共实施了9528例肝移植,其中526例的受者为18岁以下患者5。只有54.4%的移植受者在列入移植等候名单后1年内接受了移植,而等候移植患者的死亡率为每100等候名单-年(waiting-list years)死亡12.2人3。不幸的是,在列入移植等候名单的儿童患者中,有5%死亡或被认为病情过重,无法接受移植。事实上,移植前死亡率最高的人群是1岁以下儿童3。
肝移植患者的转诊、评估和选择
有肝病死亡风险的患者应转诊至肝移植中心。如图1所示,促使医师将患者转诊至肝移植中心的一个原因是既往健康的人出现肝衰竭,表现为血清转氨酶水平明显升高、精神状态改变和凝血病。急性肝衰竭的病因见表S1。在美国每年实施的肝移植中,急性肝衰竭患者占不到5% 3。其余移植手术是为了治疗慢性纤维化肝病、门静脉高压、肝癌或合并上述多种疾病患者(表S1)。从伴有门静脉高压的隐性肝硬化转变为预期寿命缩短的临床明显肝病的先兆是发生失代偿事件,如新发腹水、精神状态改变(肝性脑病)或与门静脉高压相关的消化道出血(图1)。
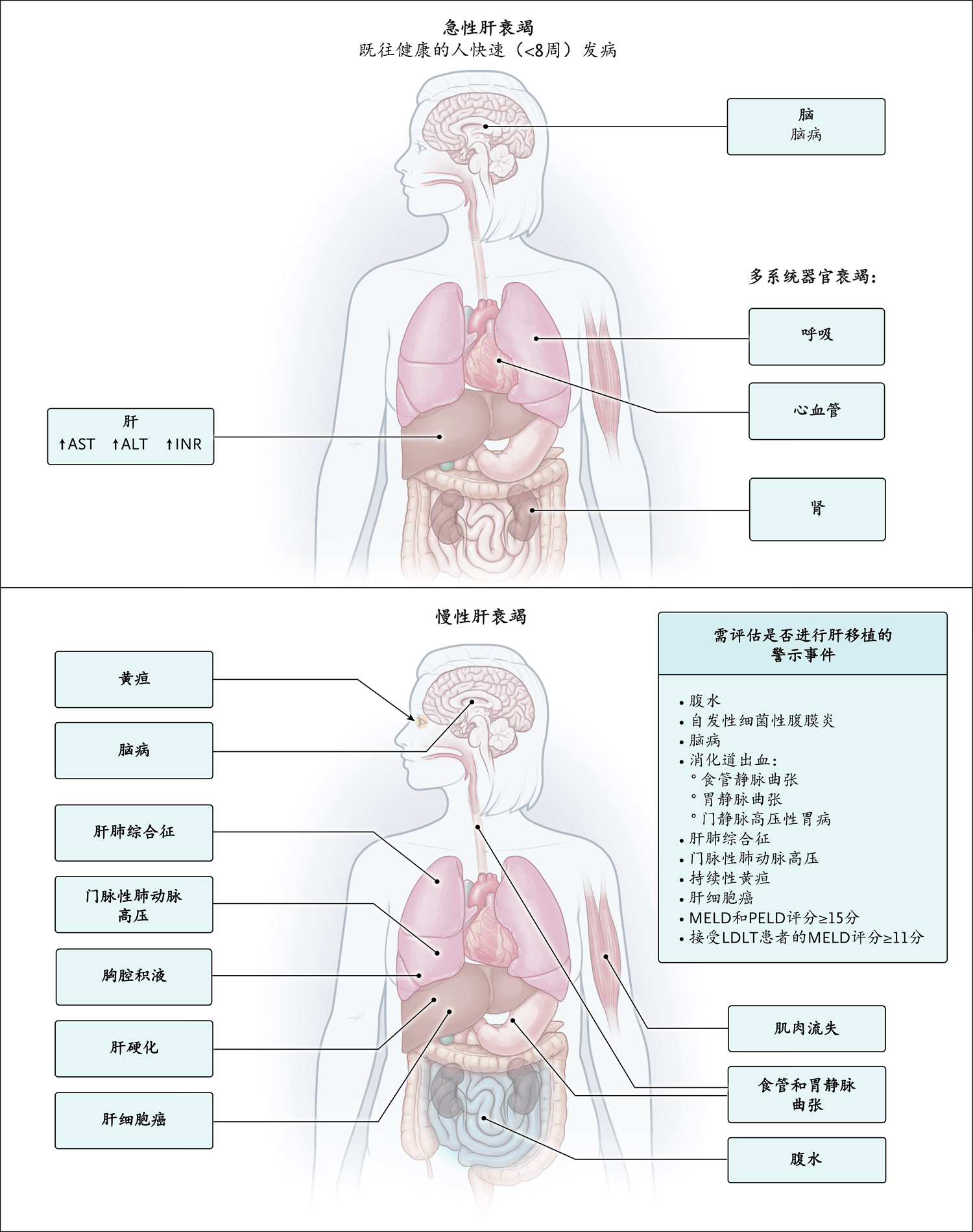
图1. 需评估是否进行肝移植的临床状况
图A显示一例急性肝衰竭患者。该患者出现多器官衰竭,天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)水平以及国际正常化比值(INR)均升高。图B显示一例慢性肝衰竭患者。GI表示消化道,LDLT表示活体肝移植、MELD表示终末期肝病模型,PELD表示儿童终末期肝病。
美国从2002年开始使用终末期肝病模型(MELD)评分,以及针对12岁以下儿童的补充性儿童终末期肝病(PELD)评分,用于评估患者是否需要接受肝移植。发生失代偿事件或有客观证据表明患晚期慢性肝病,且MELD评分≥15分(评分范围为6~40分,评分较高表示肝衰竭较严重)或PELD评分≥12分的患者,应转诊考虑肝移植。MELD和PELD评分均来自客观临床指标,关于其说明见表S2。肝硬化患者应每6个月接受一次腹部影像学检查,用于监测肝细胞癌(HCC)。监测过程中发现的可疑肝脏肿块最好由包括肝移植团队在内的多学科团队进行治疗(表1和表S1)。
表1. 肝移植禁忌证*

* AIDS表示获得性免疫缺陷综合征,HAART表示高效抗逆转录病毒治疗,HIV表示人类免疫缺陷病毒。
† 这里列出的障碍需在移植前对每个病例进行具体评估。
有关是否进行肝移植的评估包括紧迫性(依据是不进行移植的预后)和移植后取得长期成功的障碍(图2和表1)。移植前评估包括根据诊断、肝功能损害程度和合并症相关风险,对每例患者进行一系列个体化检查6。评估过程中制定以下计划:减轻合并症、评估传染病风险以及接种尚未接种的疫苗(表S1)7。COVID-19疫情凸显出确保移植候选人在免疫功能正常时(即使用免疫抑制疗法之前,因为免疫抑制疗法会抑制对疫苗的应答)完成疫苗接种的重要意义8。此外,所有患者都要接受社会心理评估,以确定其是否有充分的社会支持网络和心理健康来支撑其接受移植9。如果患者有两个器官衰竭,可能需要考虑肝肾、肝心或肝肺联合移植。
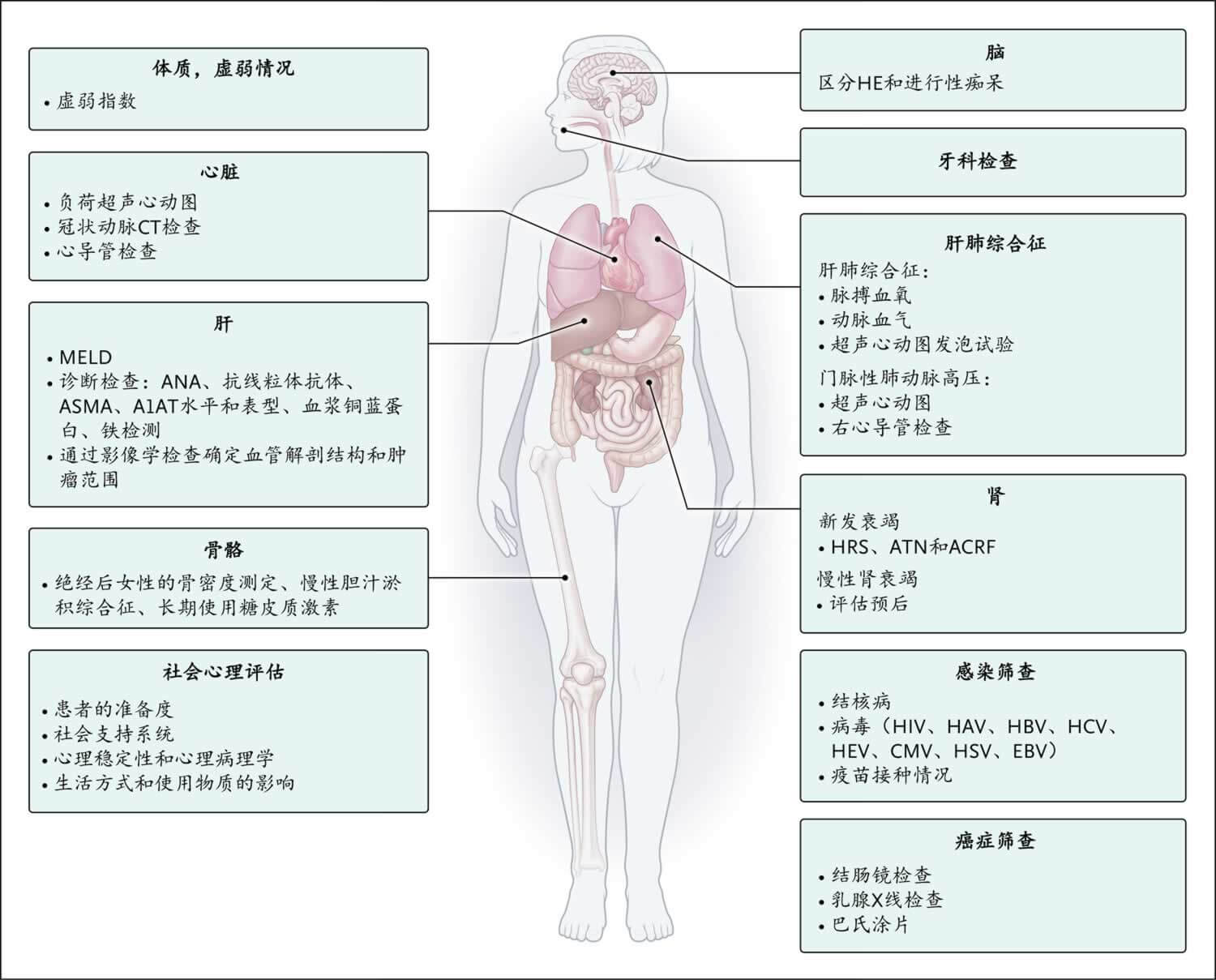
图2. 肝移植评估项目
移植前评估项目应根据诊断、肝功能损害程度和影响重要器官系统的合并症相关风险,对每位患者进行个体化评估。A1AT表示α-1抗胰蛋白酶,ACRF表示慢加急性肾衰竭,ANA表示抗核抗体,ASMA表示抗平滑肌抗体,ATN表示急性肾小管坏死,CMV表示巨细胞病毒,EBV表示EB病毒,HAV表示甲型肝炎病毒,HBV表示乙型肝炎病毒,HCV表示丙型肝炎病毒,HE表示肝性脑病,HEV表示戊型肝炎病毒,HIV表示人类免疫缺陷病毒,HRS表示肝肾综合征,HSV表示单纯疱疹病毒。
自2010年以来,西方国家列入肝移植等候名单的患者往往比以往列入名单的患者年龄更大、病情更重3。此外,直接作用的抗病毒药在高收入国家上市以来,因感染丙型肝炎病毒(HCV)被列入移植等候名单的患者人数急剧下降,而酒精相关性肝病(ALD)和代谢功能障碍相关性脂肪性肝病(MASLD)(以前称为非酒精相关性脂肪性肝病)成为了肝移植的主要适应证3,10,11。在亚洲,慢性病毒性肝炎和病毒相关性肝细胞癌仍然是移植等候名单上患者的主要诊断12。
活体肝移植
对于正在等候来自死亡供者的适合肝脏,并且死亡风险高的严重肝病患者,活体肝移植是一种救命手术(表2)。在美国,活体肝移植占所有肝移植的6%,而在中国以外的其他亚洲国家,有90%的肝移植都是活体肝移植(图S1)12。现已证明,活体肝移植后的结局与死亡供者肝移植后的结局同样好,甚至更好,MELD评分低至11分的患者也有生存获益13,14。遗憾的是,在亚洲一些国家,经济激励措施似乎刺激了活人捐献实体器官15,16。虽然在有经验的肝移植中心进行肝组织捐献被认为是安全的,但在极少数情况下,供者身体或精神健康会受到严重伤害,甚至死亡17,18。活体肝移植的要素在表2中列出,并在补充附录中说明。
表2. 活体肝移植的要素*

* BMI表示体质指数(体重[kg]除以身高[m]的平方)。
风险评分与肝移植
在美国,等候死亡供者肝脏的患者的优先顺序是根据联邦移植最终条例确定,该条例规定,移植中心必须根据最紧迫状况分配供者肝脏,同时消除因等候时间或地理位置造成的不公平现象,避免无意义的移植。MELD和PELD评分是确定候诊名单上患者优先顺序的主要工具(表S2)19,20。而在英国,自2018年起,死亡供者肝脏是根据患者的预期获益分配,而不是根据紧迫程度分配21。
MELD评分经过多次修改,以提高准确性并减少偏差(表S2)22,23。为增加移植机会,对于等候名单上的特定疾病(如HCC、门脉性肺动脉高压和肝肺综合征)患者,可在计算出的MELD和PELD评分上加额外分,因为MELD和PELD无法准确预测上述疾病的预后。对于计算出的MELD和PELD评分似乎低估需要移植的紧迫程度的患者,有一个全国性审核程序24。
癌症患者接受肝移植
广泛HCC患者如果通过成功抗肿瘤治疗在移植前缩小肿瘤体积(根据影像学检查结果),则成为可接受的移植候选人25。在美国,HCC患者接受移植术的比例从2010年的17.2%下降至2020年的12.6%,原因是2010年后,因HCC获得例外分的患者减少3。其他原发性肝癌(如肝门胆管癌或肝血管内皮瘤)患者,以及在某些情况下非原发性肝肿瘤(如神经内分泌肿瘤或转移性结肠癌)患者,也可被视为合适的移植候选人(表S1)。
ALD患者接受肝移植
1997年,美国移植学会(American Society of Transplantation)(前身为美国移植医师学会[American Society of Transplant Physicians])和美国肝病研究学会(American Association for the Study of Liver Diseases)支持将戒酒6个月作为ALD患者列入肝移植等候名单的先决条件26。2011年,Mathurin等报道,在欧洲一项小型、前瞻性先导性研究中,肝移植挽救了部分对药物治疗无效的严重酒精相关性肝炎患者的生命,这一观察结果之后得到美国一项回顾性多中心研究的支持27,28。根据目前的欧洲和美国治疗指南,选择进行肝移植的ALD患者时应基于详细的社会心理学评估,最好与酒精使用障碍的治疗相结合,而不是基于戒酒6个月这一规定29,30。社会心理学评估包括评估患者的酒精使用障碍治疗史、戒酒意愿以及为戒酒提供支持的社会网络30。根据这些指南,ALD患者中只有少数潜在的移植候选人被选中列入等候名单。在一组MELD评分较高,但戒酒情况不理想,并被拒绝列入移植等候名单的ALD患者中,90天死亡率超过50%,这说明应用于该人群的选择过程对于患者而言生死攸关31,32。
死亡供者肝脏的分配和接受
在美国,有关死亡供者肝脏分配的最新政策是根据候选人MELD和PELD评分以及他们与供者医院的距离确定他们在候选名单上的优先顺序,以减少因受者地理位置而造成的不公平现象33。对死亡供者肝脏存活能力的评估,传统上依赖供者病史,以及肝脏生化功能、外观和组织学评估。过去,使用扩展标准(存在各种潜在不利状况的供者的肝脏,如年龄>60岁、HCV检测呈阳性、肝功能检测异常、住在重症监护病房[ICU]的时间>5天,或接受支持血压的药物治疗,以及经组织学评估判断肝脏中的大脂滴脂肪>30%)获取的肝脏与较高的供者肝脏功能障碍发生率相关,功能障碍可导致移植物失功,在某些情况下甚至导致受者死亡34。遗憾的是,在美国和英国,多达70%的潜在死亡供者肝脏因上述主观评估被废弃35,36。事实上,被一个移植中心拒绝的肝脏随后可能在另一个移植中心成功移植到优先级较低的患者身上,这表明需要有更好的方法来估计供肝的存活能力37。
扩大来自死亡供者的肝脏库
大多数死亡供者肝脏来自发生不可逆性大脑和脑干损伤(宣布脑死亡),正在接受生命维持治疗的人。扩大可用的供者肝脏库的一个策略是,在仔细选择的情况下,使用感染HCV或人类免疫缺陷病毒的死亡供者的器官。另一种策略是在供者心脏死亡后获取器官,心脏死亡指的是在发生严重不可逆性神经损伤,但仍保留脑干功能的患者中,根据循环和呼吸功能停止宣布死亡。心脏死亡后的非可控型供肝(uncontrolled donation after circulatory death)是指在患者送到医院之前或在医院内复苏失败后,在供者循环停止之后获取肝脏。而心脏死亡后的可控型供肝(controlled donation after circulatory death)是指在医院可控环境下撤除供者生命维持系统后获取肝脏。心脏死亡后的非可控型供肝中的肝脏受损程度通常较大,可控型供肝是全世界更普遍采用的方法。
目前迫切需要增加可供小儿肝移植候选人(尤其是婴儿)移植的肝脏数量。考虑到肝脏的再生能力,一种似乎有助益的策略是将死亡供者肝脏劈裂,通常将一部分移植给幼童患者,另一部分移植到成人患者。英国一项研究表明,在全国实施“劈裂式肝移植政策”有可能降低等候名单上儿童的死亡率38。
移植前的供肝管理
30多年来的标准操作一直是使用4°C保存液冲洗死亡供者器官,以减少细胞代谢过程,然后在静态冷藏条件下将器官运送到移植机构39。即使静态冷藏有效,持续的低温缺血也会导致线粒体发生变化,包括细胞呼吸减少、琥珀酸和NADH积累以及ATP消耗。再灌注时,线粒体释放活性氧,导致细胞进一步损伤40,41。移植肝脏中发生的缺血再灌注损伤可能会引起临床上重要的血流动力学变化,导致组织损伤,尤其是在高危器官中,如脂肪肝、老年供者肝脏和心脏死亡后获取的肝脏。
相比之下,植入前机械灌注的目的是确保组织质量更加稳定,同时延长保存时间并降低废弃率(图3)42。用含氧溶液对供肝进行机械灌注可减轻缺血再灌注损伤,使高危肝脏的移植获得成功。
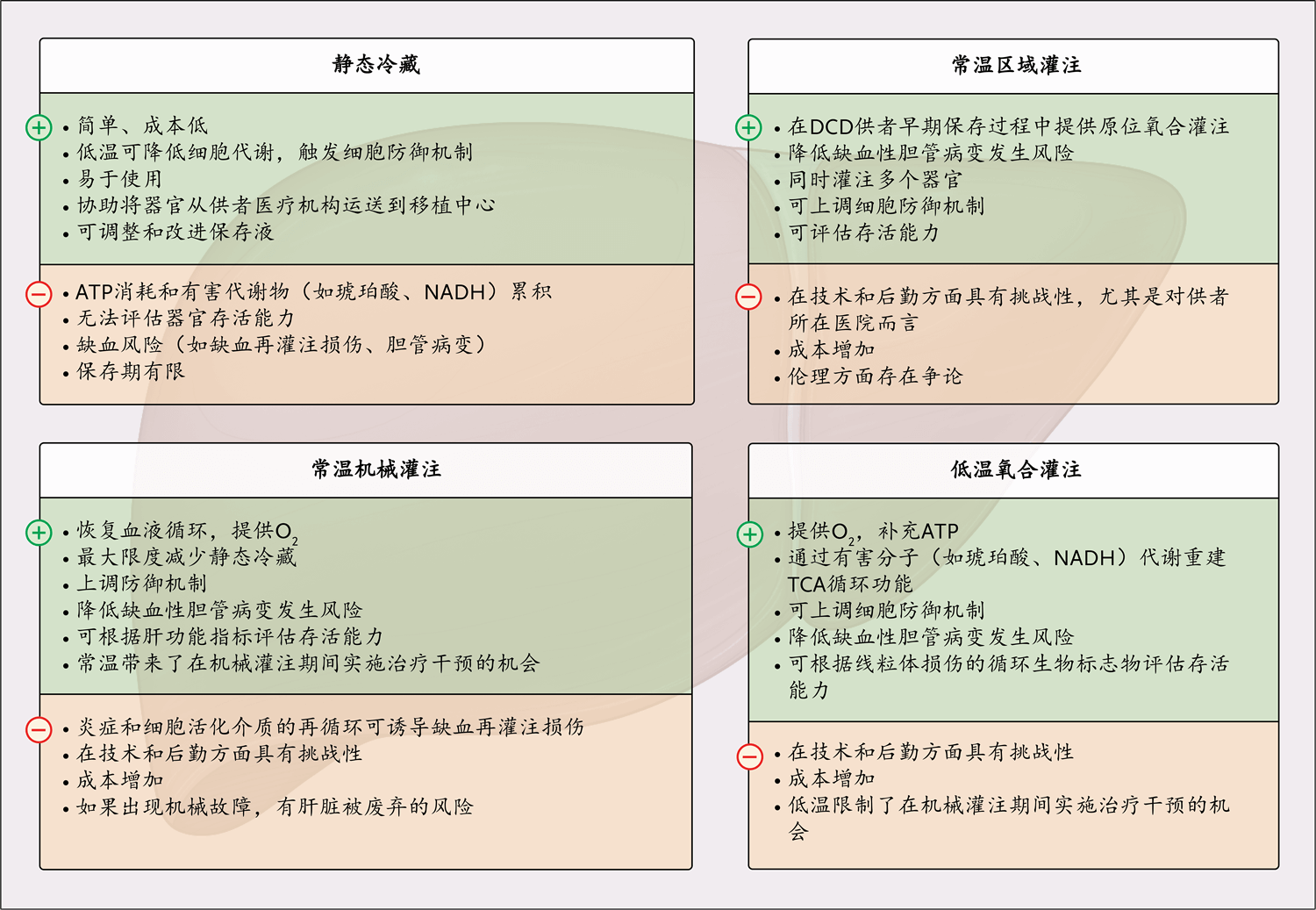
图3. 移植前的供肝管理方法
* 图中信息改编自Widmer等的论文41。正号表示系统有潜在益处,负号表示有潜在危害。DCD表示心脏死亡供者供肝,TCA表示三羧酸。
目前使用的两种体外机械灌注策略是低温机械灌注和常温机械灌注。在低温机灌注过程中,使用加入氧气的4~8°C标准低温保存液对肝脏进行动态灌注。研究表明,使用低温氧合机械灌注方式处理的心脏死亡供者供肝发生肝内胆管狭窄的风险显著低于使用静态冷藏方式保存的心脏死亡供者供肝43,44。
供肝常温机械灌注过程会通过肝动脉和门静脉同时泵ABO血型相合的37°C含氧血液。与静态冷藏相比,该方法可显著降低同种异体移植物早期功能障碍和缺血性胆管狭窄的发生率45,46。通过测量氧气使用量以及乳酸和转氨酶释放量,可以评估常温机械灌注维持的器官存活能力。
常温区域灌注是指供者发生心脏死亡后,通过提供体外膜氧合的机械循环装置,使用含氧血液对其进行体内灌注47。通过常温区域灌注,可在宣布死亡后立即对肝脏进行评估。该方法可增加心脏死亡供者供肝的使用率,并取得良好结局47,48。常温区域灌注一直是关于“死亡供者规则”(dead donor rule)的激烈伦理辩论议题,该规则规定,一个人必须先被宣布死亡,然后才能获取任何生命器官进行移植49,50。
对死亡供者器官进行机械灌注的成本高昂且非常复杂。目前缺乏比较不同灌注方案的高质量数据,也缺乏选择机械灌注类型,用于取代标准冷藏的数据标准。同样,关于在获取器官的医院进行机械灌注比较好,还是将肝脏静态冷藏运送到移植中心,然后再进行机械灌注比较好,这一点也需要阐明。
肝移植后结局
从1988—2022年,美国共实施了略超过20万例肝移植,截至2020年6月30日,共计98989名肝移植受者仍存活3,5。肝移植受者最好由移植中心的多学科团队进行治疗。该团队由一名肝病专科医师、一名外科医师、一名介入放射科医师和一名移植相关传染病专科医师组成,他们与患者的主诊医师通力合作,尤其是在维护患者健康方面,因为长期免疫抑制治疗会改变患者的许多健康状况。
每位接受肝移植的患者都有可能出现不幸结局,如围手术期死亡、缺血再灌注损伤综合征(如上所述)、同种异体移植物原发性无功能或早期功能低下,以及急性肾损伤。MELD评分较高、身体虚弱或接受高危同种异体移植的患者在ICU和医院的住院时间往往较长51。移植受者的长期治疗包括维持健康的体质指数、管理高血压和糖尿病、定期监测骨骼健康以及癌症筛查52。如果移植适应证是病毒性肝炎、自身免疫性肝病、酒精使用障碍、MASLD和原发性肝癌,则需要对肝病复发进行监测。
成人接受首次肝移植后,患者和移植物的预期1年存活率分别为94%和92%3。20世纪90年代接受移植患者的平均生存期估计为20年53。儿童期肝移植受者的1年和10年生存率分别为94.4%和90.7%,移植物的1年和10年存活率分别为90.9%和79.1%3。心脏死亡后可控型供肝受者和宣布脑死亡后供肝受者的生存期相似,但心脏死亡后供肝受者发生同种异体移植物相关疾病的可能性较高。与接受全肝移植的成人相比,在接受劈裂式肝移植的成人中,患者和移植物长期存活率都很高,但劈裂式肝移植后肝动脉血栓和胆管并发症的发生率增加54,55。与接受死亡儿科供者全肝移植的儿童受者相比,接受成人供者劈裂式肝移植、缩小体积肝移植或活体肝移植(技术变异型肝移植[technical variant graft])的儿童受者发生肝动脉血栓的几率降低,而技术变异型肝移植受者发生门静脉并发症和胆管狭窄的可能性增加56-58。
移植术后90天内出现的手术并发症可分为三大类:胆管并发症、血管并发症和出血性并发症。胆管缺血会导致肝内胆管狭窄、胆汁湖(或胆汁瘤)和胆管结石,统称为缺血性胆管病变59。心脏死亡供者供肝受者的缺血性胆管病变发生率高于脑死亡供者供肝的受者。胆管并发症可通过内镜逆行胰胆管造影术、经皮引流术或再次手术来处置,血管并发症可通过血管成形术和支架植入术、药物治疗或再次手术来处置,具体方法因各移植中心的专长而异。
同种异体移植物排斥和免疫抑制治疗
确诊T细胞介导的排斥反应需要进行肝活检60,61。肝移植术后90天内,T细胞介导的排斥反应发生率为10%~30%,但随后会降低,第一年后的发生率仅为3%3,62。活检确诊的T细胞介导的排斥反应会增加移植物失功和死亡风险,这在临床上具有重要意义,尤其是当排斥反应发生在移植术后1年以上时,有时会发展为血管病变性胆管闭塞,即慢性排斥反应62,63。T细胞介导的中度至重度排斥反应的标准治疗是大剂量糖皮质激素3天疗程,如甲泼尼龙(每天每千克体重10 mg,或最多每天1 g,连续用药3天)。抗淋巴细胞抗体等其他疗法仅用于糖皮质激素治疗无效的重度排斥反应。抗体介导的排斥反应在肝移植中的作用仍存在争议(表S4)64,65。
典型的维持性免疫抑制方案包括钙调素抑制剂(如他克莫司),通常与麦考酚酯、泼尼松或两者联用3。每种免疫抑制剂都有不良反应(表S5)。免疫抑制治疗在移植术后3~6个月内逐渐减量,因为T细胞介导的排斥风险会逐渐降低。
在接受肝移植的长期存活者中,只有不到5%的人实现足以完全停止免疫抑制治疗的耐受状态63。
肝移植受者的感染
移植后感染可能是由于受者体内的潜伏性感染复活、同种异体移植物传播感染病原体或受者体内出现了新的感染66。感染的可能性因距离手术的时间、对特定微生物的预防性用药以及免疫抑制程度而异(表S6)66。在移植术后的早期,影响血管或胆管吻合的手术并发症、伤口愈合不良或器官衰竭会导致长期辅助通气或肾脏替代疗法,这些都会增加感染并发症的风险66。第一个月后,机会性感染的风险增加,如巨细胞病毒、肺孢子虫和曲霉菌感染。在风险最大的时间段进行预防性抗微生物治疗可降低上述风险。中性粒细胞减少症会增加对细菌感染的易感性,这一情况在肝移植后很常见,而移植后使用的药物(如麦考酚酸、缬更昔洛韦和复方新诺明)会加剧中性粒细胞减少症。移植术后6个月之后,将维持性免疫抑制治疗减量通常可降低机会性感染的风险,而如果发生细胞排斥反应,其治疗方案会增加这一风险。
肝移植受者患癌症的风险
肝癌患者接受肝移植后,移植肝面临肝癌复发的风险。此外,免疫抑制与新发肿瘤相关因素之间的相互作用可能导致日晒引起的皮肤癌、吸烟者的呼吸道和上消化道癌症、结肠癌(尤其是因原发性硬化性胆管炎接受移植的患者)以及病毒相关癌症(如宫颈癌或移植后淋巴组织增生性疾病)(表S6)66,67。
儿童肝移植受者的治疗过渡
儿童时期接受肝移植的人从儿科治疗过渡到成人治疗的过程是青年很脆弱的一个时间段,在此期间,他们在用药依从性、决策和沟通技能方面尚未完全成熟68,69。美国移植学会建立了儿科过渡门户网站(Pediatric Transition Portal),为临床医师提供准备就绪情况评估工具和清单,以帮助青少年和青年受者过渡到成人治疗70。
肝移植的未来
在未来几年内,肝移植可能仍将是治疗危及生命肝病的最后手段。严重肝病新疗法的发展,或者从根本上说,与饮酒相关的两种肝病(MASLD和ALD)的社会驱动因素的减少,将减少对肝移植的需求。通过更好的工具识别无需移植也有可能康复的ALD患者,通过更好的工具预测未来饮酒情况,对ALD患者酒精使用障碍进行研究,这些都将推进对患者的治疗。一项直接的改进措施是,各移植中心更坦诚地向患者及其家属说明接受移植患者的选择过程71。我们希望,患者对免疫抑制治疗的持续需求将推动我们开发为肝移植受者诱导选择性耐受的方法72。在可预见的将来,供肝的供需矛盾可能会持续存在。如上所述,对供肝进行机械灌注可能是增加供肝供应的最大希望,机械灌注过程中,我们可以动态评估同种异体移植物存活能力,并在植入前应用治疗措施修复同种异体移植物42。我们期待着通过使用异种移植或组织工程学实现突破73,74。
著作权归作者所有。商业转载请联系作者获得授权,非商业转载请注明出处。
来源:NEJM医学前沿
链接:https://www.nejmqianyan.cn/article-info?permalinks=YXQYra2200923
转载请联系平台获得授权