急性呼吸衰竭是入住重症监护病房的常见适应证。有创机械通气(特别是正压通气)自20世纪50年代以来一直是严重急性呼吸衰竭治疗的基石1。然而,虽然重症监护管理取得了重大进展,但与插管和正压通气相关的并发症和死亡仍然不容忽视2。因此,通过使用无创装置规避有创机械通气的努力引起了广泛关注。对于某些情况,如心源性肺水肿和慢性阻塞性肺疾病(COPD)加重,无创呼吸支持极为有益3,而对于低氧血症型呼吸衰竭,相关疾病(如败血症和休克等)4可能导致无创呼吸支持存在风险,其好处难以确定。
在急性治疗环境中使用三种主要的无创支持方法:通过大口径无阻塞鼻导管(即高流量鼻导管)输送高流量气体、持续气道正压通气(CPAP)和无创通气(即呼气末正压[PEEP]的压力支持通气)。在这篇综述中,我们概述了在成人急性呼吸衰竭患者中使用无创呼吸支持的生理效应、不同的配置、临床适应证和证据。
生理效应
呼吸衰竭有两个主要组成部分:通气功能障碍和低氧血症。通气功能障碍导致呼吸困难、呼吸功增加、使用辅助呼吸肌和高碳酸血症,这种情况最好采用直接通气支持的方法来处理。低氧血症反映了气体交换不足,需要不同形式的氧疗和特定的设备设置(主要是正压)来改善气体交换。临床呼吸窘迫和严重低氧血症通常以不同的组合出现,因为导致气体交换异常的疾病通常也会导致呼吸力学异常和呼吸做功增加,但它们也可以分离5。各种无创呼吸支持的人机连接装置和方法见补充附录图S16(补充附录与本文全文可在NEJM.org获取),表S1描述了各种生理效应。
高流量鼻导管
高流量鼻导管可将吸入氧浓度(FiO2)设定为0.21~1.0,气体流速较高(≥30 L/min,高达60~80 L/min)7。通过加热(至34~37℃)和加湿使气体输送更加舒适8,高流量(通常高于患者自身吸气峰值流量)能够有效输送所需的FiO2。此外,高流量会产生不可调节的低水平PEEP(当口腔保持闭合时,PEEP水平略高),并通过呼气时冲刷上呼吸道无效腔,减少通气需求和吸气肌的做功9。这使得在每次吸气开始时都能获得FiO2可控的新鲜气体,从而略微减少了患者清除二氧化碳所需的通气量。高流量鼻导管通过阻力效应延长呼气时间延长,并降低呼吸频率10,11。此方法也可以通过湿化气体帮助黏液纤毛清除分泌物12-15,很容易使用,引起的不适通常很轻微16。
CPAP和PEEP
使用CPAP时,患者在吸气和呼气时保持恒定的正压水平呼吸17。重症监护病房的机械通气或开放回路的连续通气均可应用CPAP。后者有一个高流量气体发生器(允许FiO2调整到最高1.0)和一个最小阻力的PEEP阀。CPAP也可以通过对大气开放的阀门输送,该阀门具有内部微通道,通过微通道输送氧气射流17。这些系统也可以被加湿18。
虽然PEEP对通气无直接影响,但它可以通过各种机制间接辅助通气:在COPD加重期,平衡由呼气末残余肺泡压力(呼气末动态过度膨胀)造成的机械负荷,对抗肺不张(如腹部或胸部手术后的低氧血症),为上呼吸道提供机械性支撑作用(如在阻塞性睡眠呼吸暂停患者中),或者作为作为克服气道临界开放压力的外部压力阈值(如在肥胖患者中)19。在低氧血症患者中,当充气肺泡萎陷导致肺内分流(例如,在严重感染性肺炎或急性呼吸窘迫综合征)引起氧合受损时,PEEP可促进肺泡复张,从而改善动脉氧合20-22。当PEEP用于改善氧合时,重要的是应对PEEP对呼吸功的影响进行临床评估。PEEP过高可引起肺泡过度膨胀,降低膈肌收缩效率。
在左心室功能不全的情况下19,23,PEEP可通过增加胸腔内压力从而降低前负荷,并通过减少呼吸做功,产生有益的作用。PEEP通过减少由呼吸肌舒缩产生的胸内负压波动,降低左心室后负荷。在心功能正常的情况下,这些影响可以忽略不计,但在心源性肺水肿患者中,以CPAP或无创通气形式的PEEP通过改善心脏和呼吸功能,可以非常有效地缓解呼吸窘迫。
无创通气
无创通气是一种患者触发的、设定压力目标的通气模式,在每次患者触发呼吸时,吸气期正压均高于PEEP水平。吸气压和PEEP由医护人员设定。吸气压通过提高口腔和肺泡之间的压力梯度直接增加潮气量,使患者减少所需的呼吸用力。对于低通气和呼吸性酸中毒的患者,最好采用无创通气治疗,这将大幅度减少呼吸做功24。减少呼吸做功也可以减少氧气消耗,进一步改善气体交换25,26。对于低氧血症型呼吸衰竭患者,需要监测吸气期正压的影响,以确保潮气量不会过大,这是后续呼吸衰竭的预测指标之一27,28。
重症监护病房的呼吸机(可以补偿漏气)或者专门的“双水平”气道正压呼吸机均可应用此模式29-31。专门的双水平气道正压呼吸机有复杂的算法来补偿漏气,但它们的监测能力也低于传统的呼吸机。无创通气过程中的漏气与预设的压力有关,并可能使患者对通气感到不适17。
CPAP和无创通气的人机连接装置
无创呼吸支持的实施需要选择适当的人机连接装置。CPAP和无创通气最常用的人机连接装置是口鼻罩,面罩覆盖口鼻,用头部绑带牢固固定。面罩周围的气体泄漏限制了装置的效果,并可能导致这种方法的失败,因为无法有效地提供所需的压力30;气体泄漏也降低了潮气量监测的准确性。为了尽量减少漏气而紧密贴合的口鼻面罩,可能会导致面部溃疡并引起不适,使这种方法在很大程度上不被患者接受——特别是长期使用时。全面型面罩对鼻没有直接压力,可减少使用时造成的皮肤破损,效果与内容积较小的面罩相似32。虽然全面型面罩的内部容积较大,但它们很少会增加功能无效腔32,33。由于可输送的压力有限,鼻面罩在急症治疗中不常用。人机连接装置的舒适度对于使用CPAP或无创通气至关重要。理想情况下,临床医师应该有各种各样的人机连接装置和可用的尺寸,以便能够适当地满足个体患者的需求。
头盔是提供CPAP或无创通气的一个更大的人机连接装置。头盔是一种由透明塑料制成的圆柱形兜帽,用金属或塑料环和软领固定在脖子上。头盔用连接到颈环的两条腋下绑带固定34,35。虽然有些患者可能会有幽闭恐惧症或报告噪声过多,但头盔带来的不适通常最小,而且它不会对皮肤产生直接的局部压力。与口鼻面罩相比,头盔允许更长时间使用CPAP或无创通气。最新的设计改善了患者-呼吸机相互作用,使得PEEP水平比传统人机连接装置的水平更高(10~12 cmH2O)14,36。对于潮气量大的患者,需要较高水平的PEEP,以避免通气罩塌陷。此外,为了避免再次呼吸二氧化碳,可能需要较高的气流量。然而,在标准头盔无创通气中,准确测定呼出潮气量通常不可行37。
适应证和临床证据
下文讨论不同无创呼吸支持方法的适应证和临床研究证据。图1还总结了各种临床情况和相关证据。
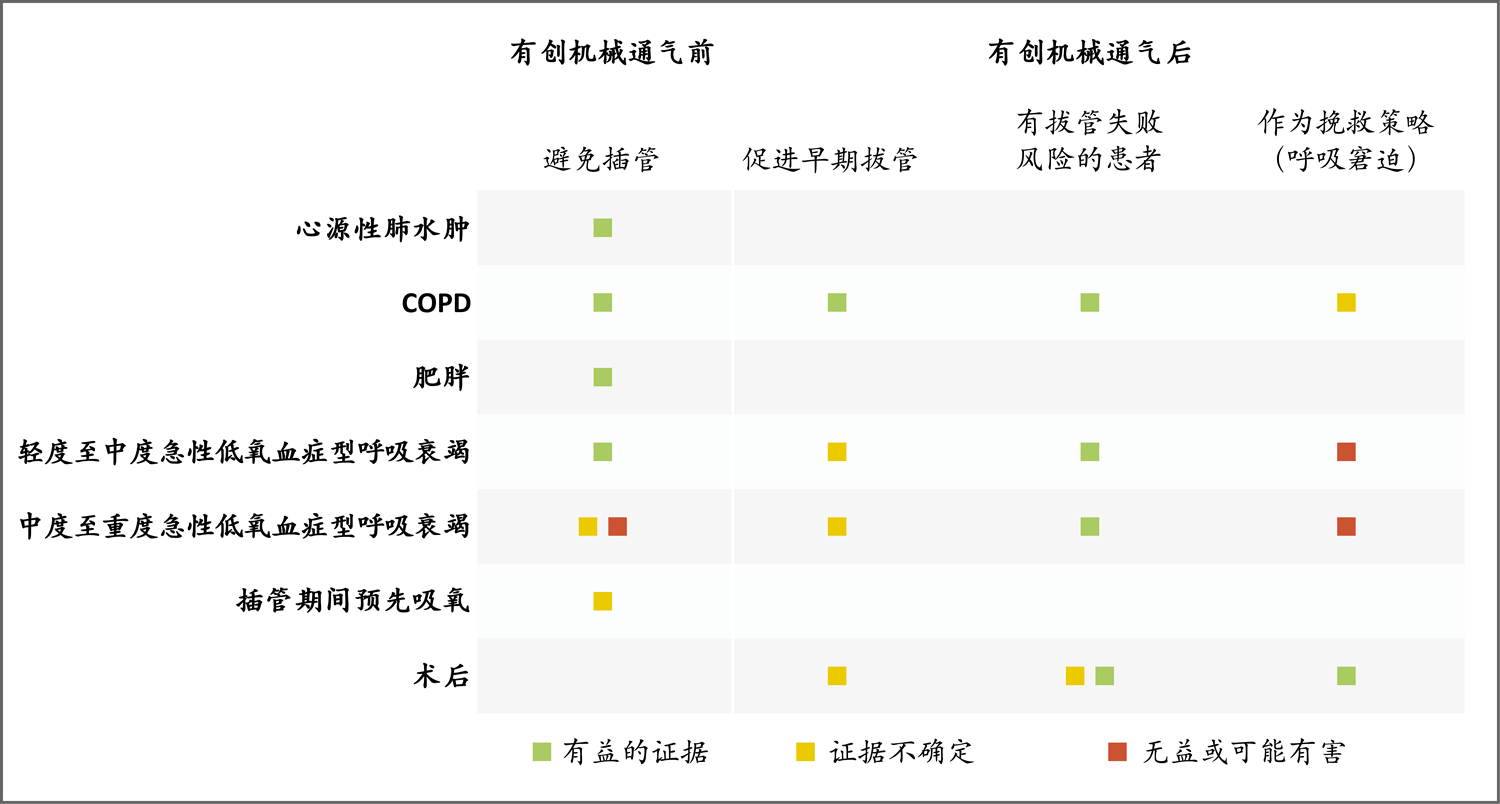 图1. 急症治疗环境中应用无创通气的证据总结
图1. 急症治疗环境中应用无创通气的证据总结
在急性低氧血症型呼吸衰竭的情况下,在部分高危患者(如肥胖或心脏病患者)中观察到优先使用无创通气获益良多。头盔无创通气和高流量鼻导管治疗中度至重度急性低氧血症型呼吸衰竭正在研究;在接受面罩无创通气时,在动脉血氧分压与吸入氧浓度比值<150的患者中,失败的风险增加。在术后拔管的情况下,没有发现腹部手术后优先使用持续气道正压的好处;然而,在高危患者和低氧血症患者中,已发现优先使用高流量鼻导管的潜在好处。腹部手术后挽救性无创通气的潜在好处也已发现。COPD表示慢性阻塞性肺疾病。
急性低氧血症型呼吸衰竭
低氧血症型呼吸衰竭的特征通常是肺部同时出现炎症或感染、血管通透性升高导致的肺水肿和肺不张,导致氧合、通气和呼吸力学受损38。有创机械通气用于气体交换恶化39和呼吸费力的情况,有创机械通气通过设定目标压力和容积,以防止呼吸机引起的肺损伤。然而,这种有创方法通常需要深度镇静。无创呼吸支持可促进气体交换,同时患者保持清醒和自主呼吸40。此外,自发产生的胸内负压对气体交换和通气分布有益。然而,至少在实验中,在病情恶化的情况下,长时间剧烈的自主呼吸也可能与伤害相关41。此外,肺外的器官功能障碍(最常见的是脑或心血管功能障碍)可能需要插管以保护气道和减少氧气消耗。虽然无创呼吸支持的有效性存在不确定性,但为了减少对插管的需要,无创呼吸支持仍被频繁使用4。事实上,在2019冠状病毒病(COVID-19)大流行期间,多达41%的重症COVID-19导致的急性低氧血症型呼吸衰竭患者采用无创通气支持;支持类型包括高流量鼻导管、CPAP和无创通气42-44。
大量的临床试验已经开展,并且一系列的荟萃分析表明,采用高流量鼻导管或无创通气治疗的低氧血症型呼吸衰竭患者气管插管的风险低于采用传统氧疗的患者。然而,对于具有此适应证的患者,对死亡率的影响并不一致3,45。
一项具有里程碑意义的试验在动脉血氧分压与吸入氧浓度(PaO2∶FiO2)之比小于300的患者中,比较了三种方法(高流量鼻导管、常规氧疗和面罩无创通气[两个疗程间使用高流量鼻导管]),结果表明,使用常规氧疗和无创通气的90日死亡风险高于单独使用高流量鼻导管46。高潮气量和低PaO2∶FiO2值(<200)与插管风险增加相关(图2)。无创通气开始后1小时的高潮气量与死亡率增加相关,这使人们开始关注无创通气下的压力是否会导致通气诱导的肺损伤。一项网络荟萃分析比较了25项试验中的所有无创呼吸支持方法,结果表明所有方法都比常规氧疗的插管风险低47。
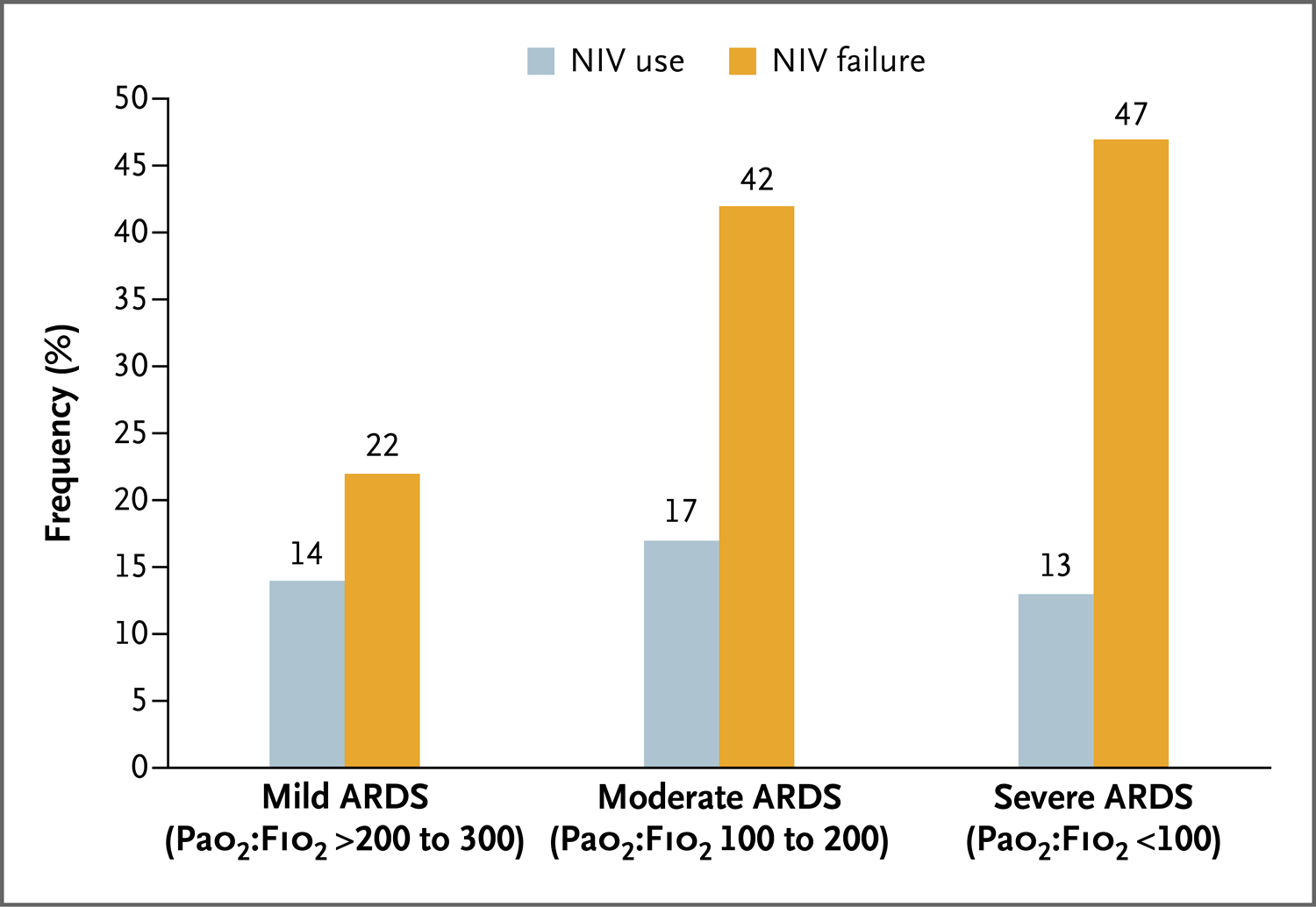 图2. 使用面罩无创通气(NIV)治疗ARDS的频率和失败的频率
图2. 使用面罩无创通气(NIV)治疗ARDS的频率和失败的频率
失败定义为气管插管。本图基于Bellani等4的数据。ARDS表示急性呼吸窘迫综合征,FiO2表示吸入氧浓度,PaO2表示动脉血氧分压。
一项小型、单中心、随机、对照试验评估了无创通气的不同人机连接装置36。使用头盔进行无创通气与使用面罩相比,插管风险较低,90日死亡率较低。虽然试验提前停止,但结果很有意义,因为此前缺乏直接比较这些人机连接装置的随机临床试验。通过头盔接受较高PEEP值(中位数,8 cmH2O)的无创通气组患者与面罩组患者(中位PEEP,5 cmH2O)相比,前者的不适感似乎较少36。在COVID-19大流行期间进行了一项试验,评估了头盔无创通气与高流量鼻导管相比的效果14。被随机分配接受头盔无创通气的患者在无创通气疗程的间隔时间接受高流量鼻导管治疗。通过头盔接受无创通气组与高流量鼻导管组相比,插管率(次要结局)较低。在COVID-19患者中进行的其他试验表明,CPAP和高流量鼻导管与常规氧疗相比,在降低插管风险方面更有效48,49。
免疫缺陷患者历来被认为是无创呼吸支持的良好人选,特别是无创通气。这一想法基于早期试验,在进行这些试验时,有创通气与该队列中极高的死亡率相关50,51。然而,随着时间的推移,免疫功能低下的呼吸衰竭患者的死亡率大幅下降52。鉴于这一变化,目前的数据不支持不惜一切代价避免有创通气,也不支持采用与非免疫功能低下患者不同的策略47。
在综合有关急性低氧血症型呼吸衰竭的文献时,我们发现所有无创呼吸支持装置都被证明比常规氧疗更有效地降低了气管插管的风险,至少在无相关情况(如严重器官衰竭或休克)的轻度至中度呼吸衰竭患者中是如此。然而,目前关于无创呼吸支持对严重呼吸衰竭(PaO2∶FiO2值<150)的益处的证据并不明确,一些数据提示面罩无创通气与潜在风险相关4。关于是否使用无创呼吸支持,使用哪种装置,与失败相关的危险因素,以及如何监测严重低氧血症患者的治疗失败等重要问题,仍不确定。表1概述了急性低氧血症型呼吸衰竭患者选择无创装置时的考虑因素和与失败相关的因素。
表1. 应用无创呼吸支持治疗急性呼吸衰竭以避免插管的实际考虑因素*
* ARDS表示急性呼吸窘迫综合征,COPD表示慢性阻塞性肺疾病,CPAP表示持续气道正压,COVID-19表示2019冠状病毒病,HFNC表示高流量鼻导管,ICU表示重症监护病房,NIV表示无创通气,OHS肥胖低通气综合征,PaO2表示动脉血氧分压,PEEP表示呼气末正压。
† ROX指数是氧饱和度除以吸入氧浓度(FiO2)与呼吸频率的比值。HACOR量表基于心率、酸中毒、意识、氧合和呼吸频率。
心源性肺水肿
对于心源性肺水肿患者,在低氧血症和呼吸窘迫时使用无创呼吸支持作为过渡治疗,同时给予紧急药物治疗(如利尿剂和血管扩张剂);在这种临床背景下,无创呼吸支持的作用是减少呼吸功耗,增加功能余气量,增强心功能。CPAP和面罩无创通气在心源性肺水肿患者中经过广泛的评估55,56。一系列系统综述表明,这些方法与气管插管风险降低和院内死亡率降低相关3。在无休克、无紧急血运重建适应证的情况下,临床实践指南建议在这种情况下使用CPAP或无创通气。从临床角度来看,当这些患者同时出现低氧血症和高碳酸血症时,使用无创通气作为首选治疗似乎是明智的。
COPD加重和高碳酸血症性呼吸衰竭
在COPD加重的情况下,使用面罩进行无创通气非常有效,因为它能有效地降低呼吸肌负荷,并抵消动态过度膨胀。这种方法通常可防止将插管作为有效治疗(如糖皮质激素、支气管扩张剂和抗生素药物)前的过渡。
一系列随机对照试验评估了与常规氧疗相比,面罩无创通气治疗COPD加重的有效性。在这些患者中,面罩无创通气在预防插管和降低院内死亡率方面均很成功3。因此,我们强烈建议将无创通气作为该人群的一线疗法。目前,没有足够的证据证明高流量鼻导管对COPD加重的作用。很少有证据支持在哮喘加重的情况下常规使用无创通气57。最后,肥胖、低通气和混合型呼吸衰竭患者在高碳酸血症和呼吸性酸中毒患者中占比越来越高58。这些患者也可能从PEEP和无创通气的驱动压力中获益59。
拔管后
研究者已经针对以下目的,对无创呼吸支持策略进行了评估:促进早期脱离有创机械通气,防止高危患者拔管失败,以及作为拔管后急性呼吸衰竭的挽救策略(图1)。利用面罩无创通气过渡,使患者早期脱离有创通气;这种脱离有创通气的策略已经完成评估。这一策略在COPD患者中取得了巨大成功,一项荟萃分析表明,住院时间缩短,死亡率降低60。
尽管满足成功拔管的标准,12%~20%的患者可能需要在拔管后1周内重新插管。与常规氧疗相比,拔管后立即应用无创通气或高流量鼻导管已成功防止某些高危人群(如COPD患者60、合并心脏病的患者或肥胖患者61)的再插管。在一项比较评估中,在有再插管风险的患者中,应用无创通气联合高流量鼻导管与单独使用高流量鼻导管相比,在第7日再插管和拔管后呼吸衰竭的风险较低62。一项事后分析发现了疗效的异质性,在肥胖(体质指数[BMI,体重{kg}除以身高{m}的平方]≥30)或超重(BMI,25~30)患者中,与高流量鼻导管组相比,无创通气组第7日在重症监护病房(ICU)重新插管和死亡的风险较低;但在体重正常或低于正常的患者中没有这种情况63。
在拔管后出现急性呼吸衰竭的患者中,应用无创呼吸支持作为一种挽救手段还没有获得很大的成功。在这种情况下,使用面罩无创通气与插管延迟和死亡率增加相关3,61,64。然而,这些发现可能不适用于COPD加重或心源性肺水肿患者,因为挽救性无创通气的试验主要在肺炎患者中进行。最后,为了监测无创通气失败和避免延迟再插管,密切监测和频繁的重新评估必不可少。
术后呼吸衰竭
考虑到术后呼吸衰竭的主要原因是肺不张或肺水肿,无创呼吸支持的疗效极具希望。最近在腹部手术患者中进行的一项大型随机试验中,与常规治疗相比,在术后拔管后30日内,优先应用CPAP并未减少肺炎、气管插管或死亡构成的复合结局65。然而,在11项试验的荟萃分析中,优先使用高流量鼻导管与常规氧疗相比,在降低插管风险方面较有效。然而,这种益处是由高危人群(如肥胖患者)驱动的66。CPAP和无创通气能有效降低腹部手术后拔管后低氧血症患者再插管和并发症的发生率67,68。
无创通气失败的监测和识别及装置选择
COPD加重病例中仅有15%~20%的病例报告无创呼吸支持失败69,但在急性低氧血症型呼吸衰竭病例中这一比例高达40%~60%4,70。失败的可能性随着呼吸衰竭的严重程度(图2)和相关合并症的增加而增加。对于有脑或循环功能障碍的患者,应非常谨慎地决定是否使用无创方法,除非可通过无创通气支持逆转功能障碍。
无创通气失败已被发现是ICU中低氧血症型呼吸衰竭患者死亡的一个独立危险因素4,71。一项试验比较了高流量鼻导管与头盔无创通气试验,该试验的二次分析发现14,在降低插管风险方面,动脉血二氧化碳分压(PaCO2)低(<35 mmHg)的患者从头盔无创通气获益最大。在PaCO2正常或更高(≥35 mmHg)的患者中未见这种影响。作者假设,低PaCO2可能代表高吸气努力,并可能定义了一个患者亚组,他们在自主呼吸时最有可能出现患者自残造成肺损伤72。虽然中等至高水平的PEEP可以通过减少肺不张和横膈努力来降低高吸气努力,并在肺部产生更均匀的压力传递73,但一些患者可能继续产生胸腔内压力大幅波动和大潮气量,这可能最终导致过度的呼吸功、耗氧、心脏超负荷或患者自残造成肺损伤74。延迟插管可能导致插管条件次优,因为这些患者几乎没有生理储备。
如表2所示,一系列生理变量已被确定与无创呼吸支持失败相关4,27,28,76。测定有害吸气努力阈值的精确可靠方法仍在研究中;吸气时食管压力的变化已被作为吸气努力的一个指标和早期预警信号进行研究76。结合呼吸变量和随时间变化趋势的综合评分也显示了识别无创呼吸支持失败的潜力。在开始使用高流量鼻导管后,在多个点计算的ROX指数(氧饱和度除以FiO2与呼吸频率的比值)与无基础慢性疾病的急性呼吸衰竭患者的这种治疗模式的失败相关53。在面罩无创通气1小时后评估HACOR评分(心率、酸中毒、意识、氧合和呼吸频率)以预测失败54。在没有基础慢性疾病的急性呼吸衰竭患者中,与无创通气方法失败相关的生理因素见表2。
表2. 急性低氧血症型呼吸衰竭患者无创呼吸支持失败的监测*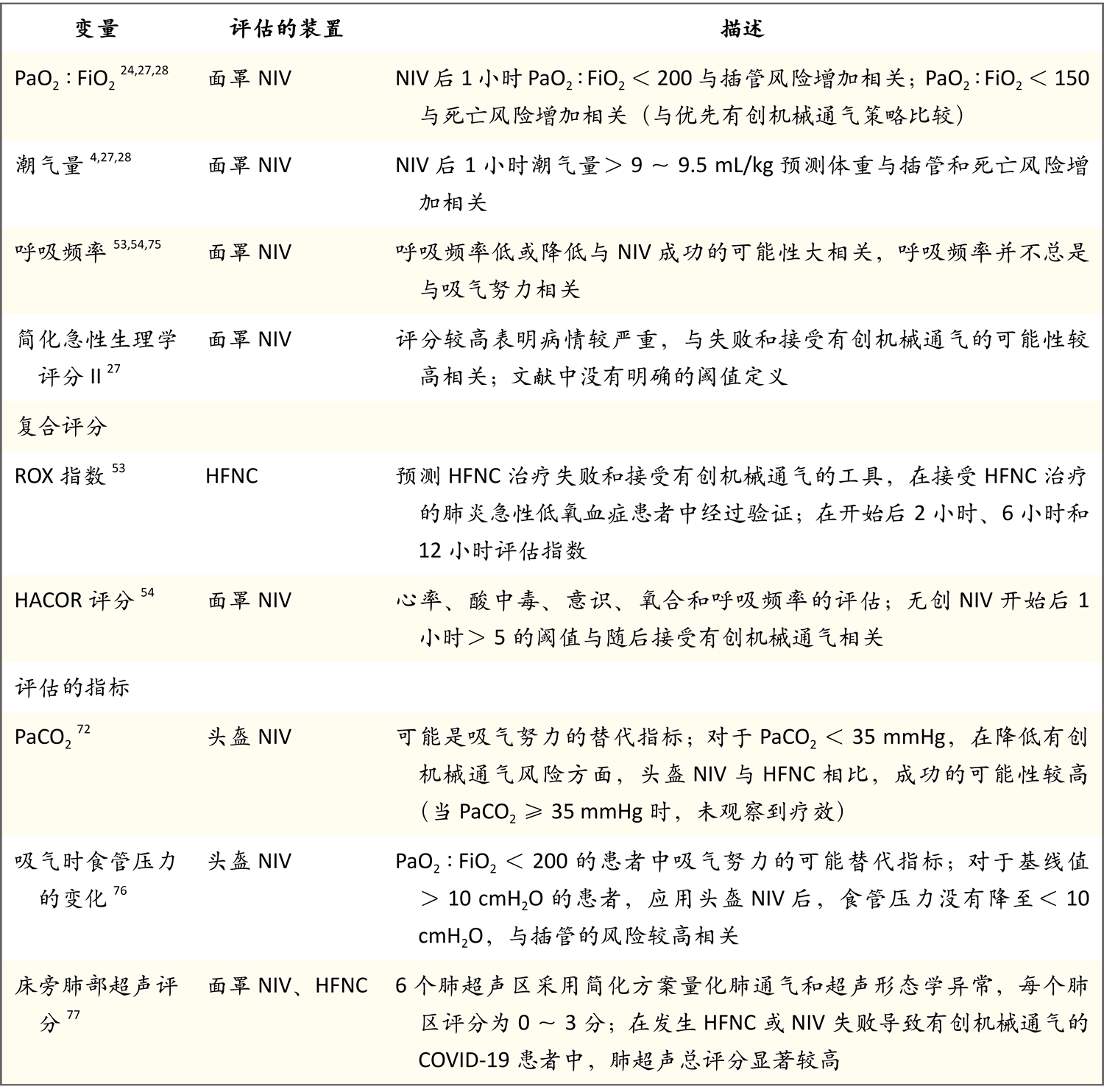
* 这些研究评估的急性低氧血症型呼吸衰竭的主要原因是肺炎。面罩可能是口鼻面罩或全面罩。PaCO2为动脉血二氧化碳分压。
考虑到失败的风险和与此风险相关的死亡率,在决定治疗非COPD、非心源性急性低氧血症性呼吸衰竭患者时必须谨慎。选择无创装置、设置、调整、监测和过渡到有创通气的决策需要根据医疗团队的特点。在许多机构,医疗团队包括熟悉并专长无创装置和人机连接装置的呼吸治疗师,有呼吸衰竭治疗经验的床旁护师,以及医师。表S1概述了与患者有关的特定因素、急性呼吸衰竭的生理因素、医疗团队和机构因素,这些因素可用于指导做出决策,选择无创呼吸支持。表1概述了使用不同的无创设备的注意事项、要监测的指标,以及失败的可能相关因素。有可能不同表型的患者对现有的无创呼吸支持的应答不同。
不确定的领域
关于无创呼吸支持的使用还有许多问题。无创呼吸支持与俯卧位等干预措施相结合的有效性、吸气努力的精确测定、镇静在减少自主呼吸相关伤害中的作用、体外气体交换方法与无创呼吸支持相结合以避免插管的作用,都是需要进一步研究的领域。
结论
不同的无创呼吸支持方法是各种疾病中支持氧合和通气的重要工具。无创呼吸支持对特定患者在避免插管和降低死亡率方面具有一定作用。避免插管的好处需要与延迟插管的危害相权衡,特别是在急性低氧血症型呼吸衰竭患者中。对失败的早期识别对于避免延迟插管很重要,因此需要仔细监测。