自发性脑出血占所有卒中的10%~15% 1。导致颅内出血的其他疾病(如创伤性出血、脑动脉瘤破裂或脑动脉畸形破裂,以及缺血性卒中的出血性转化)不是本综述讨论的内容,除非涉及鉴别诊断。
临床表现和早期评估
脑出血患者表现为局灶性神经系统体征,发病突然,但并非瞬间发生(如栓塞性缺血性卒中的情况)。病情发展一般持续几分钟。使出血性卒中有别于缺血性卒中的其他表现包括头痛、恶心或呕吐,以及见于许多病例的意识水平降低。明确区分出血性卒中和缺血性卒中需要影像学检查,在下文中讨论。意识水平降低通常表明觉醒核(arousal nuclei)和脑干上行通路受压;或者脑室内出血伴脑积水引起木僵。基底神经节出血会导致对侧偏瘫,以及由于邻近内囊横断而导致朝向出血侧的凝视偏斜。丘脑出血可因相同原因导致偏瘫,以及独特的眼部体征,包括向下和向内偏斜、瞳孔缩小和偶尔可见的“错误偏斜”(wrong-way eyes),即凝视偏斜朝向患侧;觉醒患者可能检出偏侧感觉丧失。大脑半球出血(脑叶出血)的局灶性神经功能缺损对应出血部位及白质神经纤维束横断;这些缺损包括轻偏瘫、偏侧感觉丧失和凝视偏斜,此外可能有与缺血性卒中类似的表现。脑干出血通常位于脑桥,并导致意识水平降低、脑神经麻痹、针尖样(但有反应)瞳孔、水平凝视缺失或受损、眼球浮动(眼睛快速并共轭地向下偏斜,然后缓慢向上偏斜至中间位置)和面神经无力。觉醒患者可能出现构音障碍,但中脑和脑桥上部的网状激活系统受损会导致昏迷,使我们无法检测上述体征。小脑出血通常起源于小脑半球深部的齿状核区域。症状包括眩晕、呕吐和肢体性共济失调(辨距困难,尤其是步态共济失调),最后一项可能是唯一体征,而且易被遗漏,除非将患者从床上或担架上抬下,并要求其行走。小脑出血时从脑干渗出的血液阻塞第四脑室可能导致脑积水,以及木僵或昏迷。
流行病学和危险因素
过去20年间,美国的脑出血年发病率翻了一番,达到每年约80,000例,并且估计30%~40%的脑出血病例死亡2。因为大多数脑出血幸存者有残疾,并有卒中复发、认知能力下降和患全身性血管疾病的风险,所以脑出血在神经系统疾病中具有特殊重要性。
成人脑出血的主要诱因是高血压、脑淀粉样血管病和抗凝治疗。高龄与脑出血发生率增加相关,部分原因是高龄与脑淀粉样血管病及导致患者需要抗凝治疗的心房颤动等疾病相关。过去几十年间,与维生素K抑制剂相比,口服直接抗凝剂的使用降低(但未消除)了脑出血风险。人群层面的血压控制情况改善也降低了脑出血发病率。
对1983—2006年21个国家开展的研究进行的荟萃分析显示,脑出血总发病率为24.6/100,000人-年3。风险估计值随着年龄增长而增加,此外亚裔人群的风险估计值大约是白种人人群的2倍3。在美国,黑种人和西班牙语裔人群患脑出血的风险大约是白种人的1.6倍4。
在已研究的大多数人群中,高血压是脑出血的最强危险因素5,在对血压控制疗法进行的随机试验中,亚组分析表明,降低血压可降低脑出血发病率。PROGRESS(培哚普利预防复发性卒中研究,Perindopril Protection against Recurrent Stroke Study)和SPS3(皮质下小卒中二级预防,Secondary Prevention of Small Subcortical Strokes)试验显示6,7,在为了降低总体心血管风险而设立较低血压目标的患者中,脑出血发病率低于设立较高血压目标的患者;然而,这些试验中的脑出血患者绝对数量都很少。此外,孟德尔随机化研究表明高血压多基因风险评分与脑出血风险之间存在关联8。
脑出血病理生理学和发生部位
典型的自发性脑出血发生于深部脑结构,是穿过这些区域的脑部小血管壁受损的结果。这些小动脉和微动脉在大多数情况下是大脑动脉环中大血管的分支,为基底神经节、丘脑、脑桥和小脑深部供血。高血压性脑血管病和脑淀粉样血管病首先累及这种大小的血管。
脑出血长期以来被认为是由深部小血管的微血管破裂所引起的。病理标本的观察结果提示,高血压引起壳核和丘脑出血的病理生理机制是C.M. Fisher所称的“脂质透明变性”(lipohyalinotic change),即同时出现血管壁内透明样变和脂质沉积。他的结论是,这些是血管破裂部位,而不是同样由慢性高血压引起的微动脉瘤,这一结论是对数百张连续显微切片进行细致检查后才得出的9。20世纪早期的研究认为,这些动脉瘤(Charcot-Bouchard动脉瘤)是出血原因。
脑叶出血(血肿位于额叶、顶叶、颞叶或枕叶的白质)在最近的病例系列中比脑深部出血更常见。慢性高血压也是脑叶出血的危险因素,尽管它在其中的风险程度不及在深部出血中的程度;抗凝治疗和动静脉畸形破裂在脑叶出血中所占的比例高于在基底神经节出血中所占的比例10。脑淀粉样血管病主要与脑叶出血或小脑出血相关,其原因是从软脑膜和皮质血管分支的小动脉和毛细血管中发生β-淀粉样蛋白沉积11,12。在接受抗凝治疗的患者中,尤其是脑淀粉样血管病导致脑叶出血的患者,继续接受抗凝治疗的安全性尚不明确。关于脑叶出血和非脑叶出血,正在进行的临床试验(ASPIRE [旨在预防卒中和促进康复的脑出血幸存者抗凝治疗,Anticoagulation in ICH Survivors for Stroke Prevention and Recovery;在ClinicalTrials.gov注册号为NCT03907046]和ENRICH-AF [艾多沙班用于患心房颤动的脑出血幸存者,Edoxaban for Intracranial Hemorrhage Survivors with Atrial Fibrillation;NCT03950076])将在有脑出血病史的心房颤动患者中评估与阿司匹林(第一项试验)和不采取治疗(第二项试验)相比,采用新型口服抗凝剂可否减少复发性卒中,并达到较低的脑出血发生率。
年龄大于60岁以及携带载脂蛋白(Apo)E2和ApoE4与血管内β-淀粉样蛋白沉积相关。ApoE2和ApoE4等位基因导致的脑出血风险是更常见ApoE3基因型人群的3~5倍13,14。在淀粉样血管病引起的脑出血病例中,脑部磁共振成像(MRI)常显示多处(有时数百个)不同时间发生的微小无症状出血,血管周围间隙扩张,以及之前出血事件后血液分解产物沉积引起的皮质表面铁质沉着15。
对于脑出血患者,入院时的血凝块体积是3个月时功能结局的预测指标16。在约25%的自发性脑出血病例和30%~40%的抗凝治疗相关病例中,就诊后首次脑部计算机断层扫描(CT)和第二次CT(通常在首次CT后6~24小时进行)之间会出现血凝块体积增大,这个同样可以预测结局,详见下文。导致临床体征恶化的血肿扩大与3个月时的不良功能结局尤其相关17。
继发性脑损伤在血凝块和血肿周围水肿(在脑出血后数小时内的影像学检查中可见)对脑组织造成原发性机械损伤后立即开始出现18。血肿周围水肿导致了早期神经功能恶化(程度超过仅仅由血凝块引起的功能恶化),这些改变可在数天内持续发展。血肿周围水肿的体积各不相同,但最终水肿体积可能与最初血肿体积同样大。水肿体积每增大1 mL,功能结局不良的可能性就会增加多达1倍19,20。
影像学检查
CT和MRI对于诊断急性脑出血具有灵敏度和特异性,而且可以确定血凝块位置和体积(图1)21。作为初始影像学评估的一部分,CT血管造影有可能检出脑出血背后的动脉瘤或血管畸形,这些信息有助于制定治疗决策;然而,如果血凝块完全位于脑实质内,则上述观察结果不常见。美国心脏学会发布的脑出血诊疗指南建议对70岁以下的脑叶出血患者、45岁以下的脑深部或颅后窝出血患者,以及45~70岁的无高血压病史患者进行CT血管造影22。
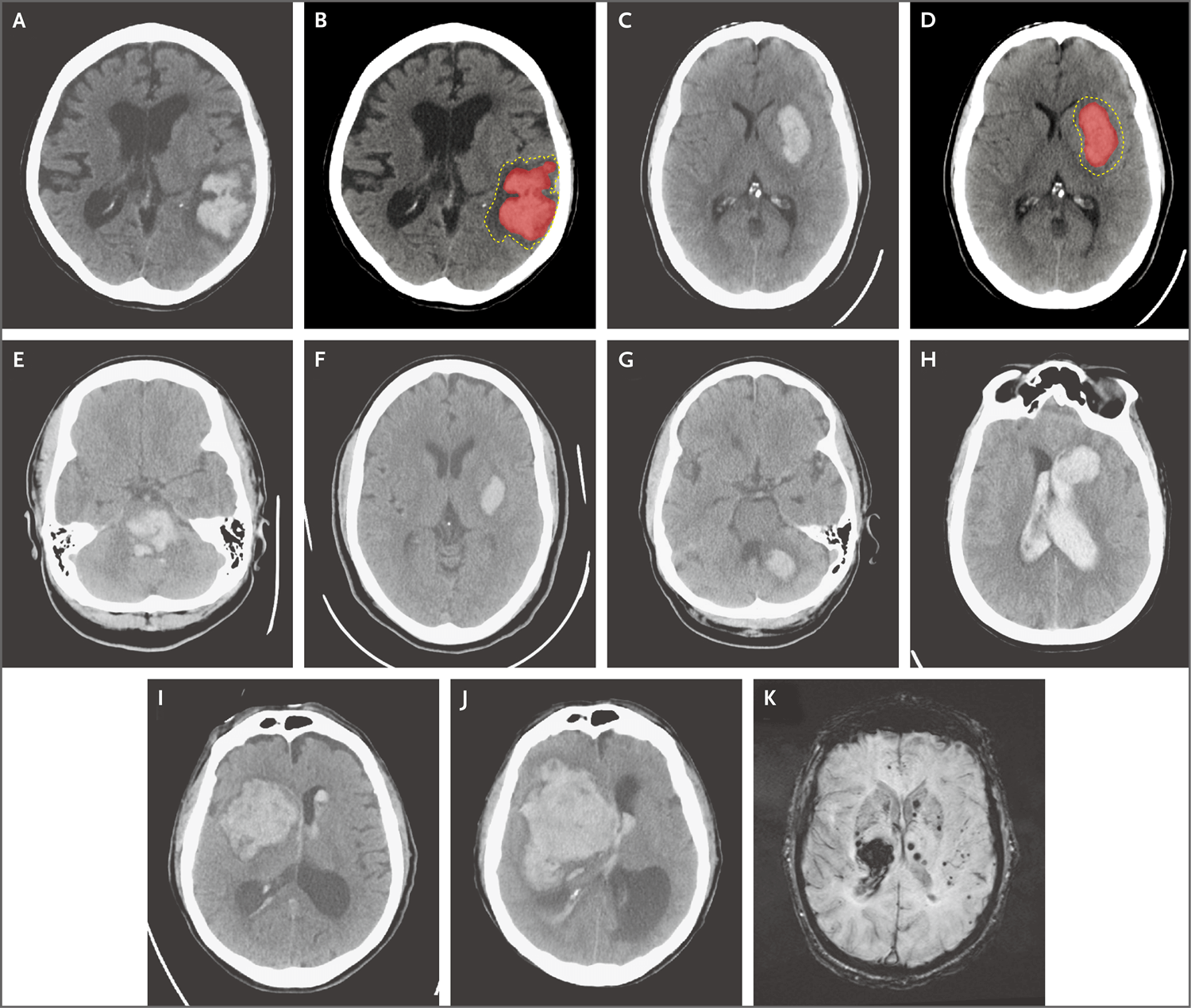 图1. 自发性脑出血
图1. 自发性脑出血
图中显示的是CT平扫(图A~J)和MRI(图K)见到的脑出血。脑叶出血(图A和B)和壳核出血(图C和D)在脑出血周围有血肿周围水肿(图B和D中用虚线勾勒出)。其他图片显示了脑干中部的脑桥出血(图E);基底神经节出血(图F);左侧小脑出血(图G);延伸到脑室的额叶出血,通常称为脑室内出血(图H);起源于基底神经节,但在就诊后几小时内血肿明显扩大的初始脑出血(图I和J);右侧丘脑出血(图K),伴有皮质旁或脑叶部位微出血,常见于磁化率成像或梯度回波序列,是脑血管淀粉样蛋白的典型表现。
评定量表
美国心脏学会建议应用几种经过验证的量表之一来早期评估脑出血严重程度22。一种常用量表是脑出血(Intracerebral Hemorrhage,ICH)评分,它包含了格拉斯哥昏迷量表(Glasgow Coma Scale)评分、患者年龄、是否有幕下出血或脑室内出血,以及血凝块体积23。初始ICH评分可估计早亡和12个月时死亡风险及功能结局24,但该量表的主要用途是提高诊疗质量,以及供医护人员讨论临床严重程度。
脑出血后早期恶化的治疗
脑出血患者的治疗重点是防止继发性脑损伤。引起最大关注且易于采取治疗的继发性损伤,包括血凝块增大、继发性脑水肿和脑室内出血。
血肿扩大
血肿扩大可引起组织破坏,程度超过仅仅由最初血凝块引起的组织破坏。这种类型的损伤并非一定会发生,它们在前文提到的系列影像学检查中很明显,通常出现在发病后6小时内。目前已评估过几种用于限制持续出血的止血疗法。在FAST(凝血因子Ⅶ治疗急性出血性卒中,Factor Seven for Acute Hemorrhagic Stroke)试验中25,患者在脑出血症状出现后4小时内被随机分配接受两种剂量之一的重组凝血因子Ⅶa或安慰剂。在接受最大剂量凝血因子Ⅶa的组中,24小时内的血凝块体积增幅要小15个百分点;然而,各组的严重残疾或死亡发生率无差异。最近启动的 FASTEST试验(NCT03496883)正在评估在发病后2小时内给予凝血因子Ⅶa,用于限制血肿扩大。
与使用抗凝剂相关的脑出血患者发生出血范围扩大、神经功能恶化和结局不良的风险是未使用抗凝剂的脑出血患者的3~6倍26。一项试验纳入了接受维生素K拮抗剂治疗且国际标准化比值(INR)大于1.9的脑出血患者,结果发现在使INR恢复正常和降低血肿扩大的发生率方面,四因子凝血酶原复合物浓缩物优于新鲜冰冻血浆27。指南建议,如果INR因使用维生素K拮抗剂而升高,则静脉注射维生素K和凝血酶原复合物浓缩物,而不是新鲜冰冻血浆22。逆转剂依达赛珠单抗和andexanet alfa可用于治疗与口服直接抗凝剂(直接凝血酶和因子Ⅹa抑制剂)相关的脑出血患者;然而,需要通过临床试验来确定其效果,有人建议,如果无逆转剂,可以用凝血酶原复合物浓缩物代替22。
为了指导抗血小板药相关脑出血患者的治疗,PATCH(抗血小板治疗相关自发性脑出血引起急性卒中后,输入血小板与标准治疗的比较,Platelet Transfusion versus Standard Care after Acute Stroke due to Spontaneous Cerebral Haemorrhage Associated with Antiplatelet Therapy)试验将患者随机分配到输入血小板的治疗组或对照组28。输入血小板组的死亡率是对照组的2倍,残疾率也更高。因此,美国心脏学会指南建议,除接受阿司匹林治疗的脑出血患者和接受神经外科手术的患者外,不应输入血小板22。
有两项试验检验了降低血压可改善脑出血患者临床结局这一假设。在ATACH-2(急性脑出血患者的抗高血压治疗Ⅱ,Antihypertensive Treatment of Acute Cerebral Hemorrhage Ⅱ)试验中,1,000例幕上出血患者被随机分成两组,两组均接受非消化道给药的尼卡地平,但维持24小时的收缩压目标范围分别为110~139 mmHg(强化治疗)和140~180 mmHg(标准治疗)29。两组在90日时的临床结局相似。在INTERACT2(急性脑出血强化降压试验2,Intensive Blood Pressure Reduction in Acute Cerebral Hemorrhage Trial 2)中30,2,783例患者被随机分配到与ATACH-2试验相同的目标血压范围,但INTERACT2研究者将干预时间延长了7日,并将降压药的选择权留给治疗医师。关于主要终点(90日时死亡或严重残疾),INTERACT2试验结果为中性。ATACH-2试验中强化治疗组的一些患者出现了急性肾损伤。这些试验完成之后,对于理想的血压目标、药物选择和给药方式,以及治疗持续时间仍然存在不确定性。然而,将目标定在收缩压130~150 mmHg的强化策略可能是合理的,尤其是脑出血后2小时内收缩压超过220 mmHg的情况下。建议密切监测肾功能和容量状态。
脑室内出血
30%~50%的脑出血患者会发生脑室内出血,而且脑室腔容积增加、脑脊液(CSF)流动受阻和炎症刺激CSF分泌所引起的脑积水会导致觉醒水平降低和结局不良31。对于导致觉醒水平降低的脑积水,治疗方式通常是放置分流CSF的脑室外引流管以及降低颅内压。在CLEARⅢ(评估通过溶解血凝块加速脑室内出血消退,Clot Lysis Evaluation of Accelerated Resolution of Intraventricular Hemorrhage )试验中,研究者在500例脑出血后脑积水患者中评估了通过阿替普酶脑室内给药的方式溶解脑室血凝块32。尽管两组间的总体比较显示功能结局无差异,但溶栓可能与生存率提高相关33。脑室内出血后幸存的患者在6个月时通常有严重残疾。
占位效应
脑内血凝块和周围水肿的占位效应所造成的最严重后果是小脑幕疝。研究表明,试图减轻小脑幕疝的血凝块清除术未获得一致结果或获得阴性结果。这些研究结果导致在通过开颅术清除血凝块方面,临床实践中做法各异。STICH Ⅱ(脑出血外科手术试验Ⅱ)试验在601例脑出血患者中评估了血凝块早期清除术的效果;结果显示,手术组和保守治疗组的不良结局发生率相似,但同时提示清除位于皮质表面1 cm内的脑叶血凝块可能有益34。
目前尚无评估小脑出血手术治疗效果的随机试验。然而,根据大量观察性研究,如果临床或影像学迹象显示脑干受压,或者如果血凝块体积大于15 mL,则通常做法是清除血凝块35。小脑出血常引起第四脑室阻塞,进而导致脑积水,这种情况需要放置脑室外引流管。
渗透疗法常用于治疗脑出血相关占位效应或水肿后继发的急性神经功能恶化,但结果尚不确定。颅内压升高常采用甘露醇或推注高渗生理盐水的方式治疗36。对于脑出血占位效应引起的疾病,目前缺乏数据支持预防性输注高渗盐水或应用糖皮质激素。
重症监护和生命维持治疗的撤除
尽管人们认为理应将脑出血患者送入ICU,但重症监护可否改善脑出血的临床结局尚不确定,而且似乎也不太可能开展试验来解答这一问题。脑出血后可发生惊厥发作,但对脑出血患者预防性使用抗惊厥药的作用尚不确定37。对于脑出血后意识水平降低的患者,连续脑电图可能检出需要开始使用抗惊厥药的隐性惊厥发作38。ICU内的常规治疗包括气道保护和肺部充分气体交换(旨在减轻低氧血症所致继发性脑损伤),但这些措施的效果很难证明。评估吞咽能力、维持正常体温和正常血糖,以及预防深静脉血栓形成(尽管存在脑出血,但该疗法被认为安全)可降低致病率。
早期预后系统可能不具有足够的预测能力来指导脑出血后生命维持治疗的撤除39。如果过早撤除生命维持治疗,原本可以活下来的患者可能会死亡40。数项研究提示,在出血后最初几天内不宜进行预后判断,这些结果与美国心脏学会指南一致22,41。通过共同决策来判断患者之前表达的意愿和家属的意愿是一种卓有成效的方法。
二级预防和重新启动抗凝治疗
在脑出血幸存者中,不到一半在出院后血压得到充分控制。血压控制不良与不良事件相关,如复发性卒中和死亡,而且控制不良的情况在黑种人中比在其他人种中更常见42。除了脑出血复发外,幸存者还面临脑部和心血管系统血栓事件的风险43。RESTART(重启或停止抗血栓治疗的随机试验,Restart or Stop Antithrombotics Randomised Trial)表明,脑出血后重新启动被认为必要(如冠状动脉支架患者)的抗血小板药会导致脑出血复发率小幅增加44。
对于脑出血合并心房颤动患者,启动或重启抗凝治疗的安全性尚不清楚。在2期APACHE-AF(心房颤动患者发生抗凝治疗相关脑出血后的阿哌沙班用药,Apixaban after Anticoagulation-associated Intracerebral Hemorrhage in Patients with Atrial Fibrillation)试验中,阿哌沙班组患者的非致死性卒中或血管原因死亡发生率略高于避免抗凝治疗的患者(26% vs. 24%)45。SoSTART(启动或停止抗凝治疗的随机试验,Start or Stop Anticoagulants Randomised Trial)表明,启动抗凝治疗的患者有8%出现脑出血复发,而未启动抗凝治疗的患者为4%,但该试验的统计学功效不足以评估卒中事件,而且未达到在脑出血后2年内避免使用抗凝剂的劣效性标准46。在心房颤动合并脑出血患者中比较凝血Ⅹa抑制剂(如阿哌沙班)与阿司匹林疗效的上述3期试验(ASPIRE和ENRICH-AF)目前正在纳入参与者。观察性研究和孟德尔随机化研究表明了低水平低密度脂蛋白胆固醇和脑出血风险之间的关系47。SATURN(他汀类药物用于脑出血患者,Statins in Intracerebral Hemorrhage,NCT03936361)试验正在评估有复发和血栓事件风险的脑叶出血患者重新启动他汀类药物治疗的情况。
未来方向
除上述正在进行的试验之外,微创手术(如抽吸、立体定向清除和脑室内溶栓)清除血凝块的试验可以确定对于不同类型和部位的血凝块,上述手术是否有效,可否改善结局。我们需要制定抗炎和神经保护疗法的评估策略。
为卒中治疗和临床试验建立组织体系可帮助我们了解患者前景。最近的小规模试验初步提示,为治疗缺血性卒中而设计的移动卒中单元也有助于脑出血的院前检测、分类和处置,但仍需进一步研究48。